
����Ŀ��̼���仯����㷺��������Ȼ�硣��ش��������⣺
��1�������ǵ�����̼Ԫ�ص�������ճء�
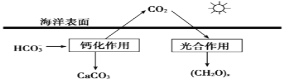
�����ں�ˮ�е�CO2��Ҫ��������̼��ʽ���ڣ�����CO2��H2CO3��___________��___________��
���ں���̼ѭ���У���ͨ������ͼ��ʾ��;����̼��д���ƻ����õ����ӷ���ʽ___________��
��2������CO2�ܽ��ں�ˮ��ʹ���ຣ���������پ���в���о������������ͼ��ʾ�����Ӻ�ˮ����ȡCO2�����Խ��ͻ�����������CO2�ĺ�����
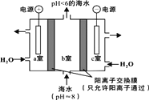
�� a�ҵĵ缫��Ӧʽ��__________��
�� ���ø�װ�ò���������X�ɴ���b���ų��ĺ�ˮ����ÿ��Żشĺϸ�ˮ��X�Ļ�ѧʽ��__________��
��3����֪��NH3��H2O��Kb=1.7��10��5��H2CO3��Ka1=4.3��10��7��Ka2=5.6��10��11����ҵ����β���е�CO2������֮һ�ǰ�ˮ��Һ���ռ��������������ǽ�������ȴ��15.5�桫26.5����ð�ˮ���չ�����CO2��������Һ��pH___________7�����������=������������������ȴ��15.5�桫26.5��Ŀ���ԭ����____________��
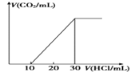
��4��Ϊ�˲���ij��ˮ����̼��������ȡ100mL��ˮ���ữ����N2����CO2������NaOH��Һ���ա�������Һ�еμ�1.0mol/L���ᣬ���ɵ�V(CO2)��V(����)�仯��ϵ��ͼ��ʾ����ԭ����Һ������Ũ���ɴ�С��˳��Ϊ__________��
���𰸡�HCO3�� CO32- ![]() 2H2O - 4e- = O2�� + 4H+��4OH--4e-= O2��+2H2O NaOH �� �������չ����а�ˮ�Ļӷ����ٽ���ˮ��CO2������ c(Na+)> c(HCO3-) > c(CO32-) > c(OH-) > c(H+)
2H2O - 4e- = O2�� + 4H+��4OH--4e-= O2��+2H2O NaOH �� �������չ����а�ˮ�Ļӷ����ٽ���ˮ��CO2������ c(Na+)> c(HCO3-) > c(CO32-) > c(OH-) > c(H+)
��������
(1)�ٶ�����̼����ˮ����̼�ᣬ̼��Ϊ���ᣬ���ֵ�������̼�����������ͼ��֪�˹���̼�����ת������̼��ƣ��ݴ���д����ʽ��
(2)��a�ҽӵ�Դ��������Ϊ������ˮʧȥ�������������������ӣ��ڸ��ݵ��ԭ�������ж������
(3)�÷�Ӧ��һˮ�ϰ��Ͷ�����̼��Ӧ����̼����泥����ݵ���ƽ�ⳣ�������ж�̼�������Һ������ԣ������¶ȶ�һˮ�ϰ��Ͷ�����̼��Ӱ��������
(4)����ͼ���֪������̼���ƺ�̼��������Һ��̼���ƺ�̼���������ʵ���֮��Ϊ1��1���������ˮ���ԭ���������
(1)�ٶ�����̼����ˮ���ɵ�̼��Ϊ���ᣬ���ֵ�������̼��������йط���ʽΪ��CO2+H2OH2CO3��H2CO3H++HCO3-�����ں�ˮ�е�CO2��Ҫ��������̼��ʽ���ڣ�����CO2��H2CO3��HCO3-��CO32-���ʴ�Ϊ��HCO3-��CO32-��
�ڷ�Ӧ���к���̼�������������Ϊ̼��ƣ�����Ԫ���غ��Լ�����غ�ó�����ʽΪ��
2HCO3-+Ca2+=CaCO3��+CO2��+H2O���ʴ�Ϊ��2HCO3-+Ca2+=CaCO3��+CO2��+H2O��
(2)��a�ҽӵ�Դ��������Ϊ������ˮʧȥ�������������������ӣ��缫��ӦʽΪ2H2O-4e-=4H++O2����4OH--4e-= O2��+2H2O���ʴ�Ϊ��2H2O-4e-=4H++O2����4OH--4e-= O2��+2H2O��
��c�ҽӵ�Դ�ĸ�����Ϊ������ˮ�õ������������������������ӣ���ˮ�к��д���Na+��ͨ�������ӽ���Ĥ�����c������NaOH�����������ƴ���b���ų��ĺ�ˮ(pH��6�ĺ�ˮ)����ÿ��Żشĺϸ�ˮ���ʴ�Ϊ��NaOH��
(3)���������ǽ�������ȴ��15.5��26.5�����ð�ˮ���չ�����CO2���÷�Ӧ��һˮ�ϰ��Ͷ�����̼��Ӧ����̼����泥���Ӧ�Ļ�ѧ����ʽΪ��NH3��H2O+CO2=NH4HCO3������NH3��H2O��Kb=1.7��10��5��H2CO3��Ka1=4.3��10��7��Ka2=5.6��10��11��֪̼��������ӵ�ˮ��̶�(Kh=![]() =
=![]() ��10��3)����笠����ӵ�ˮ��̶�(Kh=
��10��3)����笠����ӵ�ˮ��̶�(Kh=![]() =
=![]() ��10��9)����Һ�Լ��ԣ�pH��7��������ȴ��15.5��26.5�������Խ������չ����а����ӷ����ٽ���ˮ�Զ�����̼�ijɷ����գ��ʴ�Ϊ�������������չ����а����ӷ����ٽ���ˮ�Զ�����̼�ijɷ����գ�
��10��9)����Һ�Լ��ԣ�pH��7��������ȴ��15.5��26.5�������Խ������չ����а����ӷ����ٽ���ˮ�Զ�����̼�ijɷ����գ��ʴ�Ϊ�������������չ����а����ӷ����ٽ���ˮ�Զ�����̼�ijɷ����գ�
(4)Ϊ�˲���ij��ˮ����̼��������ȡ100mL��ˮ���ữ���� N2����CO2������NaOH��Һ���գ�������Һ�еμ�1.0mol/L���ᣬ���ܷ����ķ�Ӧ�Ⱥ�ΪNaOH+ HCl=NaCl+H2O��Na2CO3 + HCl = NaHCO3 +NaCl��NaHCO3 + HCl=NaCl+H2O��CO2��������ͼ���֪����Һ�к���̼�����ƺ�̼���ƣ��Ҷ������ʵ���֮��Ϊ1��1������ˮ�⣬��Һ�Լ��ԣ���Һ������Ũ�ȴ�СΪ��c(Na+)��c(HCO3-)��c(CO32-)��c(OH-)��c(H+)���ʴ�Ϊ��c(Na+)��c(HCO3-)��c(CO32-)��c(OH-)��c(H+)��


 ����������������ϵ�д�
����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�к��нϴ�����Cl����![]() ��OH����3�������ӣ����ֻȡһ�θ���Һ���ܹ��ֱ�3�����������μ������������ʵ�����˳����ȷ���ǣ�������
��OH����3�������ӣ����ֻȡһ�θ���Һ���ܹ��ֱ�3�����������μ������������ʵ�����˳����ȷ���ǣ�������
�ٵμ�Mg��NO3��2��Һ���ڹ��ˣ��۵μ�AgNO3��Һ���ܵμ�Ba(NO3)2��Һ
A.�٢ڢܢڢ�B.�ܢڢ٢ڢ�C.�٢ڢۢڢ�D.�ܢڢۢڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ӡˢͭ�Ƶ�·��ĸ�ʴҺѡȡ�ͻ���������һֱ���о����ȵ㡣
��1��Ӧ�ô�ͳʴ��Һ(HCl-FeCl3)
��ʴ��ͭ����Ҫ��Ӧ�����ӷ���ʽΪ_____��
�ڸ�ʴ������ͨ�����������ɷ����ͭ����ʵ��FeCl3��Һ������
![]()
����I�����Լ��Ͳ����ֱ�Ϊ______����ʵ�ֲ���IIת�������ʻ���____����һ�ּ��ɣ���
��2��Ӧ������ʴ��Һ(HCl-H2O2)��������ʴ�̷�Һ����������ͼ��
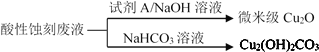
��ʴ��ͭ����Ҫ��Ӧ�����ӷ���ʽΪ_____��
�ڻ�����Cu2O�����У�������Լ�A��____������ĸ����
a.Fe�� b.������ c. NaCl���� d.����KMnO4��Һ
�ۻ���Cu2(OH)2CO3�Ĺ���������Ʒ�Ӧ���¶ȣ����¶ȸ���80��ʱ����Ʒ��ɫ��������ԭ�������_____��
��3��Ӧ�ü���ʴ��Һ(NH3H2O�CNH4Cl) ʴ��ͭ�壬����Cu(NH3)4Cl2��ˮ���ɡ�ʴ��ͭ����Ҫ��Ӧ�Ļ�ѧ����ʽΪ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���У�ʵ�������۶���ȷ�����߾��������ϵ����
ʵ�� | ���� | ���� | |
A | ��Ba(NO3)2��Һ��ͨ������������� | �а�ɫ�������� | SO2��Ba(NO3)2��Ӧ�õ�BaSO3 |
B | ��FeI2����Һ�еμ���������ˮ | ��Һ��ɫ���� | Cl2��Fe2+��Ӧ����Fe3+ |
C | ��������Һ�мӼ���ϡ���ᣬˮԡ����5min���ټ�����Cu(OH)2����� | ��ש��ɫ�������� | ����û��ˮ�� |
D | ���з�̪��Na2CO3��Һ�м�������BaCl2���� | ��Һ��ɫ��dz | ֤��Na2CO3��Һ�д���ˮ��ƽ�� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2SO2(g) + O2(g) ![]() 2SO3(g)�ǹ�ҵ���������Ҫ��Ӧ֮һ��һ���¶��£��ڼס��ҡ��������ݻ���Ϊ2 L�ĺ����ܱ�������Ͷ��SO2(g)��O2(g)������ʼ���ʵ�����SO2��ƽ��ת�������±���ʾ�������ж��У���ȷ����
2SO3(g)�ǹ�ҵ���������Ҫ��Ӧ֮һ��һ���¶��£��ڼס��ҡ��������ݻ���Ϊ2 L�ĺ����ܱ�������Ͷ��SO2(g)��O2(g)������ʼ���ʵ�����SO2��ƽ��ת�������±���ʾ�������ж��У���ȷ����
�� | �� | �� | ||
��ʼ���ʵ��� | n(SO2) / mol | 0.4 | 0.8 | 0.8 |
n(O2) / mol | 0.24 | 0.24 | 0.48 | |
SO2��ƽ��ת���� / % | 80 | ��1 | ��2 | |
A. ���з�Ӧ��ƽ�ⳣ��С����
B. ƽ��ʱ������c(SO3)�Ǽ��е�2��
C. ���¶��£�ƽ�ⳣ��ֵΪ400
D. ƽ��ʱ������O2��ת���ʴ�������O2��ת����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ΪVA��Ԫ�أ�����ұ�����̲����ĺ����ж��������账�����⡣
I.ұ����ˮ����Ԫ����Ҫ��������(H3AsO3)��ʽ���ڣ����û�ѧ�������������Ը�Ũ�Ⱥ����ˮ���乤��������ͼ��
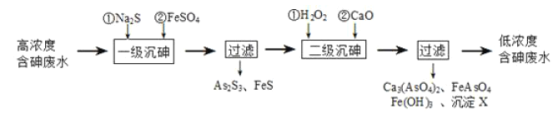
��֪����As2S3�������S2���������·�Ӧ��As2S3(s)��3S2��(aq)![]() 2AsS33��(aq)��
2AsS33��(aq)��
���������ε��ܽ��Դ�����Ӧ�����Ρ�
��1������������Ԫ�صĻ��ϼ�Ϊ____������ĵ�һ�����뷽��ʽΪ______��
��2����һ�����顱��FeSO4��������_____�����������顱��H2O2�뺬�����ʷ�Ӧ�Ļ�ѧ����ʽΪ_______��
��3������XΪ____(�ѧʽ)��
��.ұ�������е���Ԫ����Ҫ��As2S3����ʽ���ڣ��������п�ۻ�ϣ�����H2SO4���ȣ�����AsH3���塣��AsH3����ͨ��AgNO3��Һ�У�����������As2O3��
��4��AsH3�ĵ���ʽΪ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ƻ����Ľṹ��ʽΪ![]() ������˵��������ǣ� ��
������˵��������ǣ� ��
A.1molƻ�������2molNaOH�����кͷ�Ӧ
B.һ�������£�ƻ������������Ҵ����ܷ���������Ӧ
C.![]() ��ƻ���ụΪͬ���칹��
��ƻ���ụΪͬ���칹��
D.1molƻ��������������Na��Ӧ����1.5molH2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��F��G��H��Ԫ�����ڱ�ǰ�����ڳ���Ԫ�أ���ԭ���������������������Ϣ���±���
Ԫ�� | �����Ϣ |
A | ԭ�Ӻ�����6�ֲ�ͬ�˶�״̬�ĵ��� |
C | ��̬ԭ����s����������p����������� |
D | ԭ�Ӱ뾶��ͬ����Ԫ������� |
E | ��̬ԭ�����������Ų�ʽΪ3s23p1 |
F | ��̬ԭ�ӵ������p������������ӵ������������������ӵ����������෴ |
G | ��̬ԭ�Ӻ�����7���ܼ���������ߵ��ܼ�����6������ |
H | ���ҹ�ʹ������ĺϽ��е�����ҪԪ�� |
���û�ѧ������գ�
(1) AԪ����Ԫ�����ڱ��е�λ��________��A��B��C����Ԫ�صĵ�һ�������ɴ�С������Ϊ_____����Ԫ�ط�����д����
(2) BԪ���������к�����ḻ��Ԫ���γɵ��������ķ��ӹ���Ϊ____��BԪ�����γɵĵ��ʷ�����������������Ŀ֮��Ϊ____��
(3) GԪ�صĵͼ������ӵ����ӽṹʾ��ͼ��________��FԪ��ԭ�ӵ���Χ�����Ų�ͼ��________��HԪ�صĻ�̬ԭ�Ӻ�������Ų�ʽ��________��
(4) DԪ�صĵ��ʼ��䳣�����������ɫ��Ӧ��Ҫ������ԭ�ӹ����е�______��A.ԭ�����չ���B.ԭ�ӷ�����ף�
(5) ����Ԫ������p������_______����Ԫ�ط�����д����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ʷӾ��п��������ܣ����Ľṹ��ͼ������˵����ȷ���� �� ��
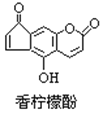
A. ���ķ���ʽΪC13H9O4
B. ����H2�����ӳɷ�Ӧ��1mol��������7mol H2
C. ����Br2ˮ������Ӧʱ��1mol�������3mol Br2
D. ����NaOH��Һ��Ӧ��1mol�������2molNaOH
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com