


 NH4++NH2���������ӻ�����Ϊl��0��l0��30���ֽ�2��3g������Ͷ��1��0 LҺ���У�����ȫ��Ӧ����NaNH2��������Һ��������䣬������Һ��NH4+��Ũ��
NH4++NH2���������ӻ�����Ϊl��0��l0��30���ֽ�2��3g������Ͷ��1��0 LҺ���У�����ȫ��Ӧ����NaNH2��������Һ��������䣬������Һ��NH4+��Ũ��
| A���������缫��Ӧʽ��Cu2++2e-��Cu |
| B�����һ��ʱ���װ�ñ���pH��С |
| C�������ͨ��������HCl���壬��ʹ��Һ�ָ������ǰ��״̬ |
| D�����һ��ʱ��������м���0.1molCu(OH)2��ʹ�������Һ��ԭ,���·��ͨ���ĵ���Ϊ0.2mol������������Һ����MgCl2,�����ܷ�Ӧ�����ӷ���ʽΪ�� |
 ��1�֣� ��KMgF3��2������������Ҳ�ɸ��֣�
��1�֣� ��KMgF3��2������������Ҳ�ɸ��֣� Mg(OH)2��+H2��+Cl2�� ��2�֣���д������1�֣� ��13��2�֣�
Mg(OH)2��+H2��+Cl2�� ��2�֣���д������1�֣� ��13��2�֣� ��
�� ��֪��þ�����ڶ��㴦�������������ϡ������������Ĵ������Ը��ݾ�̯����֪�������к��е�Mg2����F����K�������ֱ���8��
��֪��þ�����ڶ��㴦�������������ϡ������������Ĵ������Ը��ݾ�̯����֪�������к��е�Mg2����F����K�������ֱ���8��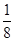 ��1��12��
��1��12��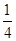 ��3��1�����Ը����ʵĻ�ѧʽ��KMgF3��
��3��1�����Ը����ʵĻ�ѧʽ��KMgF3��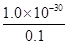 ��1��10��29 mol/L��
��1��10��29 mol/L�� Mg(OH)2��+H2��+Cl2����
Mg(OH)2��+H2��+Cl2����


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
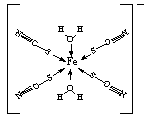
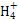 ���幹���� ,������ԭ�ӵ��ӻ���ʽΪ ��
���幹���� ,������ԭ�ӵ��ӻ���ʽΪ ��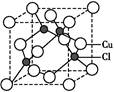
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������Ԫ�ص�ԭ���������ƶϸ�Ԫ��ԭ�ӵĺ�������� |
| B������ԭ�������������Ķ��٣��ƶ�Ԫ�ؽ����ԡ��ǽ����Ե�ǿ�� |
| C�����������Ħ���������ƶ���ͬ״̬�²�ͬ�����ܶȵĴ�С |
| D������Һ�����ʵķе㣬�ƶϽ����ֻ���Һ̬�������������Ŀ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
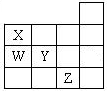
| A������ԭ���γɵĻ�ѧ���ļ��ܣ�W��Y�Ĵ� |
| B������ԭ���γɵĻ�ѧ���ļ��ԣ�X��Y���� |
| C����ͼ���̬�⻯��ķе㣺X�ı�W�ĸ� |
| D��XZ3�ľ����������Ӿ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| Ԫ�� | ���ʻ�ṹ��Ϣ |
| A | ���ʳ�����Ϊ���壬������ˮ������CS2�����γ�2�ֶ�Ԫ�����ᡣ |
| B | ԭ�ӵ�M����1��δ�ɶԵ�p���ӡ�����p������������7�� |
| C | ����������Ϊ����ɫ�Ľ��ӡ�������γɵĺϽ����ں������������������ǿ���ǿ� |
| D | ԭ�Ӻ�����Ӳ���s����������p����������2�������ʺ��������Ϊ�ռ���״���壬���кܸߵ��ۡ��е㡣 |
| E | ��������������β������Ҫ�к��ɷ�֮һ��Ҳ�ǿ�������Ԥ����ָ��֮һ����Ԫ���������谷�к����ϸߡ� |
| F | ���ڱ��е縺������Ԫ�� |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

 ������Ŀ֮��Ϊ ��
������Ŀ֮��Ϊ ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������


�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com