
【题目】下列事实不能说明元素的金属性或非金属性相对强弱的是
序号 | 事实 | 推论 |
A | 与冷水反应,Na比Mg剧烈 | 金属性:Na > Mg |
B | Ca(OH)2的碱性强于Mg(OH)2 | 金属性:Ca > Mg |
C | SO2与NaHCO3溶液反应生成CO2 | 非金属性:S > C |
D | t℃时,Br2+H2 I2+H2 | 非金属性:Br > I |
A. A B. B C. C D. D
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】端炔烃在催化剂存在下可发生偶联反应,称为Glaser反应,2R—C≡C—H![]() R—C≡C—C≡C—R+H2。该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:
R—C≡C—C≡C—R+H2。该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:
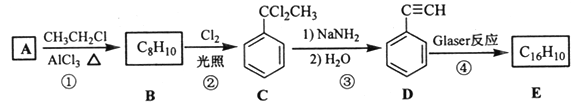
回答下列问题:
(1)B的结构简式为______,D 的化学名称为______。
(2)①和③的反应类型分别为______、______。
(3)E的结构简式为______。用1 mol E合成1,4二苯基丁烷,理论上需要消耗氢气_______mol。
(4)化合物(![]() )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。
(5)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3:1,写出其中3种的结构简式_______________________________。
(6)写出用2苯基乙醇为原料(其他无机试剂任选)制备化合物D的合成路线___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组,通过下图装置进行硫酸与铜反应的实验探究。
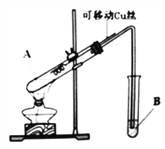
⑴提出假设:
假设一:加热时,稀H2SO4与Cu能反应。
假设二:加热时,浓H2SO4与Cu能反应。
⑵设计实验:
实验编号 | 实验操作 | 实验现象 |
1 | 将Cu丝与稀H2SO4接触,加热 | 试管B中溶液无明显变化 |
2 | 将Cu丝与浓H2SO4接触,加热 | 试管B中溶液褪色 |
实验前,试管B盛放的是_______________溶液(填“品红”或“酚酞”)。
⑶实验结论:通过以上实验,说明浓硫酸具有____________________(填写字母代号)。
A.强氧化性 B.脱水性 C.吸水性
⑷问题与计论:
①有同学认为该装置不完善,Cu与浓H2SO4反应生成了一种大气污染物,该气体是________;他建议在试管B口塞一团棉花,该棉花最好浸泡下列哪种溶液__________(填字母编号);
A.稀盐酸 B.NaOH溶液 C.NaCl溶液
②该兴趣小组在探究Cu与浓H2SO4反应时,将质量5.0g可移动Cu丝部分伸入浓H2SO4中,充分反应后,Cu丝剩余3.4g,将试管A中液体稀释成100ml溶液。该溶液中Cu2+物质的量浓度为_____mol·L-1 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中A与B反应生成C,其反应速率分别用v(A)、v(B)、v(C)表示。已知:(A)、v(B)、v(C)之间有以下关系2v(B)=3v(A),3v(C)=2v(B),则此反应可表示为( )
A.2A+3B=2CB.A+3B=CC.3A+B=2CD.A+B=C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组同学为探究黑木耳中含铁量,进行如下实验。
已知:i.黑木耳富含蛋白质、糖类、卵磷脂、铁及一些还原性物质(如维生素![]() )等。每100克黑木耳含铁高达185毫克。
)等。每100克黑木耳含铁高达185毫克。
ii.紫色的![]() 溶液在酸性条件下具有强氧化性,其还原产物是无色的
溶液在酸性条件下具有强氧化性,其还原产物是无色的![]() 。
。
I:为确定黑木耳中含有铁元素,甲同学设计实验方案如下。
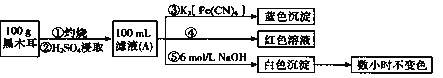
(1)步骤②得到滤液A的操作是_________。
(2)步骤④检验![]() 所用试剂是_________溶液。
所用试剂是_________溶液。
(3)下列有关上述实验得出的结论是_____(填字母符号)。
a.黑木耳中一定含![]() 和
和![]()
b.滤液A中一定含![]() 和
和![]()
c.白色沉淀中一定含![]()
II:为测定黑木耳中铁元素的含量,乙同学设计实验方案如下。
![]()
(4)可选作试剂B的物质是__________(填字母序号)
a. ![]() b.
b. ![]() c.
c. ![]() d.
d. ![]()
(5)步骤⑦中观察到的实验现象是_________,反应的离子方程式是____________。
(6)若同学实验操作规范,但测得含铁量远大于实际的含量,其可能的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于工业生产的叙述,错误的是 ( )。
A.制普通玻璃的主要原料是纯碱、石灰石、石英
B.氨是制作氮肥、硝酸、铵盐的重要原料
C.将二氧化硫催化氧化生成三氧化硫后,在吸收塔内用水吸收制得浓硫酸
D.制造普通水泥的主要原料是黏土、石灰石
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素.请回答下列问题:
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为______.
(2)W与Y可形成化合物W2Y,该化合物的电子式为______.
(3)Y在周期表中的位置是______.
(4)比较W、X、Y、Z四种元素简单离子的半径大小(用化学式表示,下同):______;比较Y、Z的气态氢化物稳定性强弱:______>______.
(5)X的硝酸盐水溶液显______性,用离子方程式解释原:______.
(6)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为:______.
(7)Z的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量.写出该反应的热化学方程式:______.
(8)以N2、H2 为电极反应物,以HCl—NH4Cl为电解质溶液制造新型燃料电池,放电过程中,溶液中NH4+浓度逐渐增大,写出该电池的正极反应式:_______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 加水稀释0.01 mol·L-1的CH3COOH溶液,溶液中c(OH-)减小
B. 室温时,0.1 mol·L-1的某一元酸HA在水中有0.1%发生电离,则该溶液的pH=4
C. 氨水加水稀释后,溶液中![]() 的值增大
的值增大
D. 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com