
【题目】Na2CO3溶液中存在水解平衡:CO32-+H2O![]() HCO3-+OH-。下列说法错误的是( )
HCO3-+OH-。下列说法错误的是( )
A.加水稀释,溶液中所有离子的浓度都减小B.通入CO2,溶液pH减小
C.加入NaOH固体,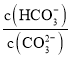 减小D.升高温度,平衡常数增大
减小D.升高温度,平衡常数增大
科目:高中化学 来源: 题型:
【题目】如图为铜锌原电池示意图,下列说法正确的是

A. 锌片逐渐溶解 B. 烧杯中溶液逐渐呈蓝色
C. 电子由铜片通过导线流向锌片 D. 该装置能将电能转变为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,E为浸有Na2SO4溶液的滤纸,并加入几滴酚酞。A、B均为Pt片,压在滤纸两端,R、S为电源的电极。M、N为惰性电极。G为检流计,K为开关。试管C、D和电解池中都充满KOH溶液。若在滤纸E上滴一滴紫色的KMnO4溶液,断开K,接通电源一段时间后,C、D中有气体产生。
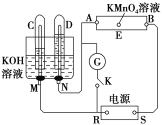
(1)R为电源的__,S为电源的__。
(2)A极附近的溶液变为红色,B极的电极反应式为__。
(3)滤纸上的紫色点移向__(填“A极”或“B极”)。
(4)当试管C、D中的气体产生到一定量时,切断外电源并接通开关K,经过一段时间,C、D中气体逐渐减少,主要是因为_,写出有关的电极反应式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
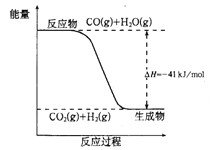
【题目】(1)化学反应过程中,不仅有物质的变化,还伴随有能量的变化。根据下图写出反应的热化学方程式__________。
(2)化学反应速率和化学平衡是化学反应原理的重要组成部分。将4.0 molPCl3和2.0 molCl2充入10L恒容密闭容器中,在一定条件下发生反应PCl3(g)+Cl2(g) ![]() PCl5(g),经2 min达到平衡时,PCl5为0.40 mol。
PCl5(g),经2 min达到平衡时,PCl5为0.40 mol。
①在0~2min内,用Cl2表示的反应速率为:![]() (Cl2) =_____mol/(L·min) ;
(Cl2) =_____mol/(L·min) ;
②达到平衡时,PCl3的转化率为________;
③如果再通入1.0 molCl2,相同温度下重新达到平衡时,PCl5的物质的量________。(填字母代号)
A.增大 B.减小 C.不变
(3)水的电离与溶液的酸碱性密切相关。
①常温下,某柠檬水溶液的pH=3,其中的c(OH-)=______mol/L;
②常温下,浓度均为0.1mol/L的CH3COOH溶液和CH3COONa溶液中,水的电离程度大小关系是:前者____后者(填“大于”、“小于”或“等于”);
③常温下,浓度均为0.1mol/L的NaX和NaY两种盐溶液,其pH分别为8和10,则HX和HY的酸性强弱关系是:HX____HY(填“>”或“<”)。
(4)研究化学能与电能相互转化的装置、过程和效率的科学,叫做电化学。
①某原电池装置如图,则该原电池的负极是____(填“Zn”或“Cu”),正极的电极反应式为_______;
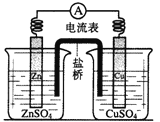
②用铂电极电解某金属氯化物(XCl2)的溶液,当收集到2.24L Cl2(标准状况)时,阴极增重6.4g,则该金属的相对原子质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型超高能材料是国家核心军事力量制高点的重要标志,高性能炸药BNCP的结构如图,回答下列问题:
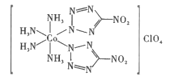
(1)BNCP中Co3+的基态价层电子轨道表示式是__,Co3+的配位数是__,阴离子ClO4-的中心原子杂化类型是__。
(2)1mol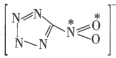 配体中的σ键的数目是__,已知该配体是平面结构,图中标记的N原子与O原子之间的σ键是由N原子的__杂化轨道与O原子的__轨道重叠形成的。
配体中的σ键的数目是__,已知该配体是平面结构,图中标记的N原子与O原子之间的σ键是由N原子的__杂化轨道与O原子的__轨道重叠形成的。
(3)比较NO2+、NO2、NO2-的键角大小:__,与NO2-互为等电子体的单质是___。
(4)比较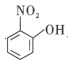 、
、![]() 的沸点并说明理由:__。
的沸点并说明理由:__。
(5)比较H2O与OF2的极性大小并说明理由:__。
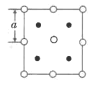
(6)2018年南京理工大学胡炳成团队合成全国首个全氮阴离子,全氮阴离子的盐AgN5的晶体结构中:N5-采取面心立方最密堆积,Ag+填在正四面体空隙中,从晶胞上方的俯视投影图如图。每个晶胞中含有的N5-的数目是__。Ag+与N5-最近的距离是__(用a表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是以环戊烷为原料制备环戊二烯的合成路线:
![]()
(1)X的名称为__,Y的结构简式为__,反应②的反应试剂和反应条件为__。
(2)金刚烷是一种重要的化工原料,工业上可通过下列途径制备:

环戊二烯分子的分子式为__;
二聚环戊二烯的同分异构体中,属于芳香烃且苯环上的一氯代物有3种的同分异构体的结构简式为__,__。
金刚烷的一氯代物有__种;金刚烷与四氢二聚环戊二烯的关系是___。(填字母)
a.互为同系物 b.互为同分异构体 c.均为烷烃 d.均为环烃
(3)写出环戊二烯在一定条件下生成高聚物的结构简式:__。
(4)烯烃也能发生如下反应:![]() R1CHO+
R1CHO+![]() +HCHO。
+HCHO。
请写出下列反应的有机产物的结构简式:![]() __。
__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度、温度、压强、催化剂对化学反应速率有影响,合成氨反应N2+3H2![]() 2NH3,在其他条件不变时,改变下列条件对化学反应速率影响不正确的是( )
2NH3,在其他条件不变时,改变下列条件对化学反应速率影响不正确的是( )
A.增大N2或H2的浓度,达到化学平衡时,正反应速率增大,逆反应速率减小
B.升高温度正、逆反应速率均增大
C.减小压强正、逆反应速率均小
D.加入正催化剂,缩短达到化学平衡所需要的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯氧布洛芬具有良好的解热、镇痛、抗炎、抗风湿作用 ,苯氧布洛芬的合成路线:
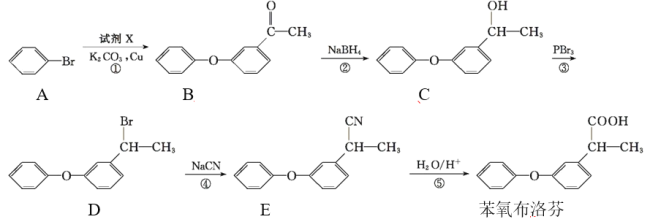
回答下列问题:
(1)苯氧布洛芬中官能团的名称为____。
(2)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。A~D四种物质中,含有手性碳的有机物为____(填字母)。
(3)反应②的反应类型是____。
(4)若过程①发生的是取代反应,且另一种产物为HBr,由A生成B发生反应的化学方程式为____。
(5)有机物M与C互为同分异构体,M满足下列条件:
Ⅰ.能与FeCl3溶液发生显色反应,1 mol M可消耗2 mol NaOH;
Ⅱ.M分子中有6种不同化学环境的氢,核磁共振氢谱为3∶2∶2∶2∶2∶3,且分子中含有![]() 结构。
结构。
写出符合条件的M的一种结构简式:____。
(6)根据已有知识并结合相关信息,写出以丙酮(CH3COCH3)为原料制备2-甲基丙酸的合成路线流程图(无机试剂任用)。_________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com