
【题目】某实验小组用工业上废弃固体(主要成分Cu2S和Fe2O3)混合物制取粗铜和Fe2(SO4)3晶体,设计的操作流程如下:
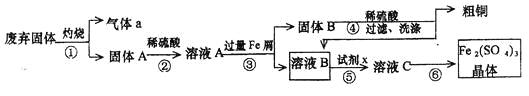
(1)除酒精灯和铁架台(或三脚架)外,①中所需的容器为_____;①和⑥中都用到的玻璃仪器为_______;
(2)已知试剂x为过氧化氢,写出H2O2与溶液B反应的离子方程式___________;
(3)某同学取少量的溶液B向其中加入过量的某种强氧化剂,再滴加KSCN溶液,发现溶液变红色,放置一段时间后,溶液褪色,该同学猜测溶液褪色的原因是溶液中的SCN-被过量的氧化剂氧化所致。
现给出以下试剂:1.0 mol·L-1硫酸、1.0 mol·L-1NaOH溶液、0.1 mol·L-1Fe2(SO4)3.;溶液、20%KSCN溶液、蒸馏水。请你设计合理实验验证该同学的猜测是否合理。简要说明实验步骤和现象_______。
【答案】坩埚 玻璃棒 )2Fe2+ + H2O2 + 2H+ =2Fe3+ + 2H2O 取少量褪色后的溶液于试管中,逐滴加入过量的20%KSCN溶液,如溶液变红色,说明该同学的猜测是合理的,如不变红色,说明猜测不合理(或滴加过量的0.1 mol·L-1Fe2(SO4)3溶液,如溶液不变红色,说明合理,若变红色,说明猜测不合理)
【解析】
(1)①是固体灼烧,需要坩埚,所以除酒精灯和铁架台(或三脚架)外,①中所需的容器为坩埚;⑥是蒸发,因此①和⑥中都用到的玻璃仪器为玻璃棒;
(2)溶液A和过量铁反应生成溶液B,则溶液B中含有亚铁离子,亚铁离子具有还原性,能被双氧水氧化反应的离子方程式为2Fe2+ + H2O2 + 2H+=2Fe3+ + 2H2O;
(3)如果溶液褪色的原因是溶液中的SCN-被过量的氧化剂氧化所致,则可以继续向溶液中滴加KSCN溶液看是否变红色,即实验方案可设计为取少量褪色后的溶液于试管中,逐滴加入过量的20%KSCN溶液,如溶液变红色,说明该同学的猜测是合理的,如不变红色,说明猜测不合理。(或滴加过量的0.1 mol·L-1Fe2(SO4)3溶液,如溶液不变红色,说明合理,若变红色,说明猜测不合理)。


科目:高中化学 来源: 题型:
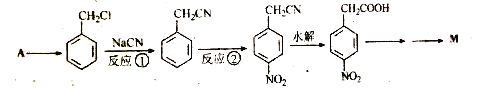
【题目】阿克他利M( )是一种抗风湿性关节炎药物,其合成路线如下:
)是一种抗风湿性关节炎药物,其合成路线如下:
完成下列填空:
(1)反应①的反应类型为_______________。
(2)反应②所用的试剂为_________________。
(3)写出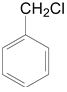 的所有含苯环结构的同分异构体的结构简式。_______________
的所有含苯环结构的同分异构体的结构简式。_______________
(4)写出由对硝基苯乙酸(![]() )得到对硝基苯乙酸乙酯的试剂和条件。______________
)得到对硝基苯乙酸乙酯的试剂和条件。______________
(5)A的分子式为C7H8,写出由A合成苯甲醛的合成路线。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是三种稀酸对![]() 合金随Cr含量变化的腐蚀性实验结果,下列有关说法正确的是
合金随Cr含量变化的腐蚀性实验结果,下列有关说法正确的是
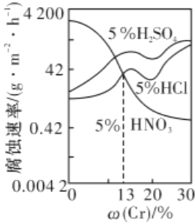
A.稀硝酸对![]() 合金的腐蚀性比稀硫酸和稀盐酸的弱
合金的腐蚀性比稀硫酸和稀盐酸的弱
B.稀硝酸和铁反应的化学方程式是:Fe+6HNO3(稀)![]() Fe(NO3)3+3NO2↑+3H2O
Fe(NO3)3+3NO2↑+3H2O
C.Cr含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对![]() 合金的腐蚀性最强
合金的腐蚀性最强
D.随着Cr含量增加,稀硝酸对![]() 合金的腐蚀性减弱
合金的腐蚀性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁镁合金是目前已发现的储氢密度较高的储氢材料之一,其晶胞结构如图所示(黑球代表Fe,白球代表Mg)。则下列说法不正确的是( )
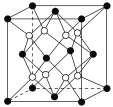
A. 铁镁合金的化学式为Mg2Fe
B. 晶体中存在的化学键类型为金属键
C. 晶格能:氧化钙>氧化镁
D. 该晶胞的质量是![]() g(NA表示阿伏加德罗常数的值)
g(NA表示阿伏加德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某碳素钢锅炉内水垢的主要成分是碳酸钙、硫酸钙、氢氧化镁、铁锈、二氧化硅等。水垢会形成安全隐患,需及时清洗除去。清洗流程如下:
Ⅰ.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸和少量NaF溶液,浸泡;
Ⅲ.向洗液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉。
(1)用NaOH溶解二氧化硅的化学方程式是__________________________________。
(2)已知:20℃时溶解度/g
CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
1.4×10-3 | 2.55×10-2 | 9×10-4 | 1.1×10-2 |
根据数据,结合化学平衡原理解释清洗CaSO4的过程________________________。
(3)在步骤Ⅱ中:
① 被除掉的水垢除铁锈外,还有_______________________________________。
② 清洗过程中,溶解的铁锈会加速锅炉腐蚀,用离子方程式解释其原因________。
(4)步骤Ⅲ中,加入Na2SO3的目的是_______________________。
(5)步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe2O3保护膜。
① 完成并配平其反应的离子方程式:______
![]()
②下面检测钝化效果的方法合理的是______。
a.在炉面上滴加浓H2SO4,观察溶液出现棕黄色的时间
b.在炉面上滴加酸性CuSO4溶液,观察蓝色消失的时间
c.在炉面上滴加酸性K3[Fe(CN)6]溶液,观察出现蓝色沉淀的时间
d.在炉面上滴加浓HNO3,观察出现红棕色气体的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氯化铁溶液中存在下列平衡:FeCl3+3H2O![]() Fe(OH)3+3HC1;△H>0。回答下列问题:
Fe(OH)3+3HC1;△H>0。回答下列问题:
(1)加热FeCl3溶液,溶液的颜色会不断加深,可得到一种红褐色透明液体,向这种液
体中加入MgCl2溶液,产生的现象为 。
(2)不断加热FeCl3溶液,蒸干其水分并灼烧得到的固体可能是 。
(3)在配制FeCl3溶液时,为防止浑浊,应加入 。
(4)为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入MgCO3固体,过滤
后再加入足量盐酸。MgCO3固体能除去Fe3+的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)按下图所示装置进行实验,并回答下列问题:
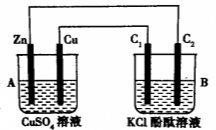
(1)判断装置的名称:A池为 ,B池为 ;
(2)锌极为 极,铜极上的电极反应式为 ,
石墨棒C1为 极,电极反应式为 ,
石墨棒C2附近产生的现象为 ;
(3)当C2极析出气体224mL(标准状况),锌的质量变化为 g(“增加”或“减少”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mA(s)+nB(g)![]() pC(g) △H<0,在一定温度下,平衡时B的体积分数与压强变化的关系如图所示,则下列叙述正确的是( )
pC(g) △H<0,在一定温度下,平衡时B的体积分数与压强变化的关系如图所示,则下列叙述正确的是( )

①m+n<p ②x点的状态是v正>v逆 ③n>p ④x点比y点的反应速度慢 ⑤若升高温度,该反应的平衡常数增大
A. ①②④ B. ②④
C. ③⑤ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D四种短周期主族元素,A分别与B、C、D结合生成甲、乙、丙三种化合物,且甲、乙、丙三分子均为10电子粒子,C、D结合生成化合物丁。有关元素的单质和甲、乙、丙、丁四种化合物的转化关系如图所示。
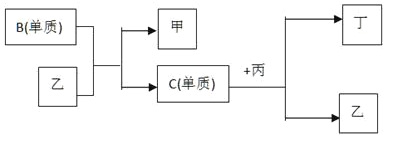
(1)根据以上条件可以确定A、B、C、D四种元素中的三种元素。不能被确定的第四种元素是____(填A、B、C、D中的一种)。
(2)依据下列条件可以进一步确定上述第四种元素:①甲与丙以及乙与丙均能够发生反应;②甲、丙都是无色、有刺激性气味的物质。据此,写出C+丙=乙+丁的化学方程式:___________。
(3)NH3H2O的电离方程式为NH3H2O![]() NH4++OH-,试判断NH3溶于水后形成的NH3H2O的合理结构 ________(填字母代号)。
NH4++OH-,试判断NH3溶于水后形成的NH3H2O的合理结构 ________(填字母代号)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com