
【题目】金属钙的冶炼方法是电解法,这一事实说明了( )
A. 金属钙离子易得电子变成金属钙原子B. 金属钙是不活泼的金属元素
C. 金属钙原子易失去电子变成钙离子D. 金属钙离子的氧化性很强
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】H2O2(l)在有MnO2条件下和无MnO2条件下分解的能量变化如图所示。下列说法正确的是
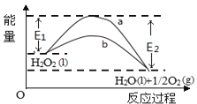
A. 有MnO2 条件下的反应曲线是a曲线
B. 该反应能量变化类型与CaCO3分解反应相同
C. 加催化剂后,正反应速率加快,逆反应速率减小
D. b曲线的热化学方程式为:H2O2(l) =H2O(l) +1/2O2(g) ΔH= ( E1 - E2 )kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对反应2A(g)+2B(g)![]() 3C(g)+D(?),下列图象的描述正确的是
3C(g)+D(?),下列图象的描述正确的是
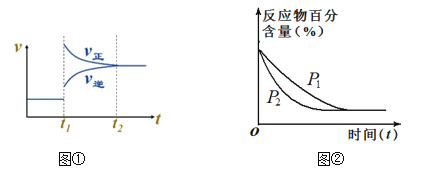
A. 依据图①,若t1时升高温度,则ΔH<0
B. 依据图①,若t1时增大压强,则D是固体或液体
C. 依据图②,P1>P2
D. 依据图②,物质D是固体或液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组微粒在指定溶液中一定能大量共存的是( )
A.稀硫酸溶液:NH4+、Al3+、Cl-、K+
B.使酚酞变红的溶液:Na+、HSO3-、Cl-、Ba2+
C.FeCl2溶液:H+、NO3-、Ag+、K+
D.无色透明的溶液:H+、Na+、MnO4-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示进行电化学实验,电极材料为铜和另一电极X,则以下说法中错误的是( )

A. 铜电极上既可能发生反应:Cu-2e- =Cu2+,又可能发生 Cu2++2e- =Cu
B. 该装置既可实现化学能转化成电能,又能实现电能转化成化学能
C. X电极上既可能产生H2,又可能产生O2
D. 该装置既可做电镀铜的实验,又可以研究精炼铜的原理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料和燃料,CO、CO2在催化剂的作用下都可以合成甲醇。
Ⅰ. 工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g)+2H2(g)![]() CH3OH(g) ΔH
CH3OH(g) ΔH
(1)判断反应达到平衡状态的依据是___________(填字母)。
A. CH3OH的浓度不再发生变化 B. 生成CH3OH的速率与消耗CO的速率相等
C. 氢气的体积分数保持不变 D. 混合气体的密度不变
(2)为研究平衡时CO的转化率与反应物投料比![]() 及温度的关系,研究小组在10 L的密闭容器中进行模拟反应,并绘出下图。
及温度的关系,研究小组在10 L的密闭容器中进行模拟反应,并绘出下图。
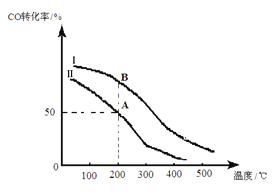
①反应热△H_______0(填“>”或“<”),判断依据是__________________________。
②若其他条件相同,Ⅰ、Ⅱ曲线分别表示投料比不同时的反应过程。
a. 投料比:Ⅰ______Ⅱ(填“>”、“<”或“=”)。
b. 若Ⅱ反应的n(CO)起始=10 mol、 投料比为0.5,A点的平衡常数KA =________,B点的平衡常数KB_______KA (填“>”、“<”或“=”)。
③要提高CO的转化率,可以采取的措施是_______________。(填字母)
a. 升温 b. 加入催化剂
c. 增大压强 d. 加入惰性气体
Ⅱ. 用CO2在催化剂的作用下合成甲醇的反应为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)某密闭容器中充入3 mol氢气和1 mol二氧化碳,测得混合气体中甲醇的体积分数与温度的关系如下图所示。
CH3OH(g)+H2O(g)某密闭容器中充入3 mol氢气和1 mol二氧化碳,测得混合气体中甲醇的体积分数与温度的关系如下图所示。
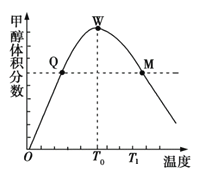
(1)下图中Q点的速率υ正_______υ逆(填“>”、“<”或“=”)。
(2)解释T0~T1内甲醇的体积分数变化趋势的原因_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是新一代饮用水的消毒剂,许多发达国家的自来水厂采用ClO2代替Cl2来进行自来水消毒。我国最近成功研制出制取ClO2的新方法,其反应的微观过程如下图所示:
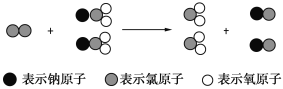
下列有关该反应的叙述中正确的是 ( )
A. 该反应是置换反应
B. 该反应的化学方程式为Cl2+NaClO2===ClO2+NaCl
C. 反应中Cl2既是氧化剂,又是还原剂
D. 氧化性: Cl2 > ClO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
铂(Pt)及其化合物的用途广泛。
(1)在元素周期表中,铂元素与铁元素同族,则铂元素位于_______。
A.s区 B.p区 C.d区 D.ds 区 E.f区
(2)二氯二吡啶合铂是由Pt2+、Cl-和吡啶结合形成的铂配合物,有顺式和反式两种同分异构体。科学研究表明,反式分子和顺式分子一样具有抗癌活性。
①Cl-的外围电子排布式为_______。
![]()
②吡啶分子是大体积平面配体,其结构简式如右图所示,该配体的配位原子是_____。吡啶分子中,碳、氮原子的轨道杂化方式分别是____、____,各元素的电负性由大到小的顺序为_______。
③二氯二吡啶合铂分子中存在的微粒间作用力有______(填序号)。
a.离子键 b.配位键 c.金属键 d.非极性键 e.氢键
④二氯二吡啶合铂分子中,Pt2+的配位数是4,但是其轨道杂化方式并不是sp3。
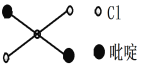
简述理由:_____________________________。
⑤反式二氯二吡啶合铂分子结构如右图所示,该分子
是_______分子(选填“极性”、“非极性”)。
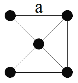
(3)金属铂晶体中,铂原子的配位数为12,其面心立方晶胞沿 x、y或z轴的投影图如右图所示。若金属铂的密度为d g·cm-3,则晶胞参数a=____________nm(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2011年3月11日在日本发生的大地震中,福岛核电站发生了核泄漏,其周边区域的空气中漂浮着放射性物质,其中含有碘的同位素13153I,13153I中的质子数为
A. 53 B. 78 C. 131 D. 184
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com