
【题目】甲醇是重要的化工原料和燃料,CO、CO2在催化剂的作用下都可以合成甲醇。
Ⅰ. 工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g)+2H2(g)![]() CH3OH(g) ΔH
CH3OH(g) ΔH
(1)判断反应达到平衡状态的依据是___________(填字母)。
A. CH3OH的浓度不再发生变化 B. 生成CH3OH的速率与消耗CO的速率相等
C. 氢气的体积分数保持不变 D. 混合气体的密度不变
(2)为研究平衡时CO的转化率与反应物投料比![]() 及温度的关系,研究小组在10 L的密闭容器中进行模拟反应,并绘出下图。
及温度的关系,研究小组在10 L的密闭容器中进行模拟反应,并绘出下图。
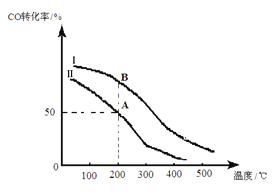
①反应热△H_______0(填“>”或“<”),判断依据是__________________________。
②若其他条件相同,Ⅰ、Ⅱ曲线分别表示投料比不同时的反应过程。
a. 投料比:Ⅰ______Ⅱ(填“>”、“<”或“=”)。
b. 若Ⅱ反应的n(CO)起始=10 mol、 投料比为0.5,A点的平衡常数KA =________,B点的平衡常数KB_______KA (填“>”、“<”或“=”)。
③要提高CO的转化率,可以采取的措施是_______________。(填字母)
a. 升温 b. 加入催化剂
c. 增大压强 d. 加入惰性气体
Ⅱ. 用CO2在催化剂的作用下合成甲醇的反应为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)某密闭容器中充入3 mol氢气和1 mol二氧化碳,测得混合气体中甲醇的体积分数与温度的关系如下图所示。
CH3OH(g)+H2O(g)某密闭容器中充入3 mol氢气和1 mol二氧化碳,测得混合气体中甲醇的体积分数与温度的关系如下图所示。
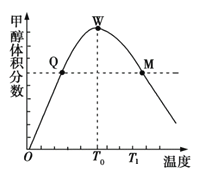
(1)下图中Q点的速率υ正_______υ逆(填“>”、“<”或“=”)。
(2)解释T0~T1内甲醇的体积分数变化趋势的原因_______________________。
【答案】 AC < 温度升高,CO的转化率降低,平衡逆向移动了,说明正反应是放热反应 < 1 = c > 正反应是放热反应,温度升高,平衡逆向移动了,所以T0~T1内甲醇的体积分数降低
【解析】Ⅰ.(1)根据变量不变规律,判断反应是否达到平衡状态;
(2)①升高温度,一氧化碳转化率减小,正反应为放热反应;②由于增大氢气的浓度有利于提高CO的转化率,所以根据图像可知曲线在温度相等的条件下曲线I的转化率大;根据三段式计算出A点的平衡常数,同一个反应,温度相同,平衡常数相同;有利于反应向右进行,可以增大一氧化碳转化率。
Ⅱ.T0对应的W点表示平衡状态,T0之前为反应正在向右进行,未达平衡,T0之后,为升高温度,平衡发生移动,甲醇的体积分数减小,平衡左移,正反应放热,据此分析解答。
Ⅰ. (1) 反应达到平衡状态时, CO、 H2、CH3OH的浓度都不再发生变化,所以能作为判断平衡状态的根据, A正确;无论反应是否达到平衡状态,生成CH3OH的速率与消耗CO的速率始终相等,且方向同向,所以不能作为判断平衡状态的根据, B错误;反应达到平衡状态时,各物质浓度不变,氢气的体积分数保持不变,反应达到平衡状态,C正确;混合物的质量始终不变,容器的体积不变,所以混合气体的密度始终不变,所以不能作为判断平衡状态的根据, D错误;正确选项AC。
(2)①根据图像可知在压强相同的条件下,升高温度,CO的转化率降低, 这说明平衡左移,因此正反应为放热反应,△H<0;正确答案:<;温度升高,CO的转化率降低,平衡逆向移动了,说明正反应是放热反应。
②a.由于增大氢气的浓度有利于提高CO的转化率,所以根据图像可知曲线在温度相等的条件下曲线I的转化率大,所以投料比:Ⅰ<Ⅱ;正确答案:<。
b.若Ⅱ反应的n(CO)起始=10 mol、 投料比为0.5,则氢气是20mol。A点转化率是0.5,即消耗5molCO,则同时消耗1mol氢气,生成5mol甲醇。所以平衡时CO、氢气、甲醇的浓度分别是0.5mol/L、1mol/L、0.5mol/L,则A点的平衡常数KA=![]() ;平衡常数只与温度有关系,则B点的平衡常数KB=KA;正确答案:1;=。
;平衡常数只与温度有关系,则B点的平衡常数KB=KA;正确答案:1;=。
(3)由于正反应是体积减小的放热反应,升高温度,平衡左移,CO转化率减小,a错误;而使用催化剂对平衡没有影响,CO转化率不变,b错误;增大压强,平衡右移,转化率增大,c正确;加入惰性气体,总压增大,分压不变,平衡不动,CO转化率不变,d错误;正确选项c。
Ⅱ.(1)T0对应的W点表示平衡状态,达到平衡后,升高温度,甲醇的含量降低,说明平衡向右进行,正反应为放热反应,Q点时反应正在向右进行,未达平衡,所以υ正>υ逆;正确答案:>。
(2)由于该反应正反应是放热反应,温度升高,平衡逆向移动了,所以T0~T1内甲醇的体积分数降低;正确答案:正反应是放热反应,温度升高,平衡逆向移动了,所以T0~T1内甲醇的体积分数降低。


科目:高中化学 来源: 题型:
【题目】在2A+B ![]() 3C+4D反应中,表示该反应速率最快的是
3C+4D反应中,表示该反应速率最快的是
A. v(A)=0.5mol·L-1· s-1B. v(B)=0.3 mol·L-1· s-1
C. v(C)=0.8 mol·L-1· s-1D. v(D)=10 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验内容、实验装置和对应的实验目的均正确的是
A. 测定中和热 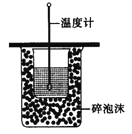
B. 比较Cu2+、Fe3+对反应速率的影响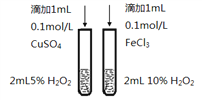
C. 比较醋酸和硼酸的酸性强弱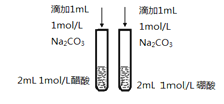
D. 比较温度对化学反应速率的影响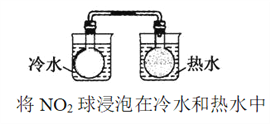
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关NH3的性质特点,描述错误的是:
A. 极易溶于水,可与水做喷泉实验
B. 液氨能作制冷剂
C. 工业上常用氮气和氢气合成氨气
D. 常温下是无色无味气体,密度比空气小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钙的冶炼方法是电解法,这一事实说明了( )
A. 金属钙离子易得电子变成金属钙原子B. 金属钙是不活泼的金属元素
C. 金属钙原子易失去电子变成钙离子D. 金属钙离子的氧化性很强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,下列五种物质①溴水、②氢氧化钠溶液、③液溴、④氢气、⑤浓硝酸,其中能与苯发生化学反应的是( )
A. ①③⑤B. ①②⑤C. ③和⑤D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列性质递变不正确的是( )
A. 酸性:HClO4>H2SO4>H3PO4 B. 半径:Cl—>Na+>F—
C. 热稳定性:HF>HCl>HBr D. 还原性:Cl—<Br—<I—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下3.2g CO与CO2的混合气体,体积为2.24L。则:混合气体的平均摩尔质量是________ CO2和CO的体积之比是________ CO2和CO的质量之比是_______,混合气体中所含氧原子的物质的量是_______
(2)若10 g密度为ρ g·cm-3的Ca(NO3)2溶液中含有4 g Ca2+,则溶液中NO3-的物质的量浓度为____________
(3)在标准状况下,将V L A气体(摩尔质量为M g·mol-1)溶于0.1 L水中,所得溶液的密度为ρ g·cm-3,则此溶液的物质的量浓度(mol·L-1)为 ____________________
(4)在反应3BrF3+5H2O===9HF+Br2+HBrO3+O2↑中,若有2molH2O参加反应,有_____mol水作还原剂,被水还原的溴元素____________mol;
(5)把V L含MgSO4和K2SO4的混合溶液分成五等份,一份加入含a mol NaOH的溶液恰好使镁离子完全沉淀;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为_______
(6)3.04g铜镁合金完全溶解于50mL密度为1.40g·mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体2240mL(标准状况),向反应后的溶液中加入1.0mol·L-1NaOH溶液,当金属离子全部沉淀时,得到5.08g沉淀,则该浓硝酸中HNO3的物质的量浓度是 ___mol·L-1,镁的质量为______g,NO2和N2O4的混合气体中,NO2的体积分数是___,得到5.08g沉淀时,加入NaOH溶液的体积是____mL。
(7)在100mL FeBr2溶液中通入2.24L Cl2(标准状况),溶液中有1/3的溴元素被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com