
【题目】下列性质递变不正确的是( )
A. 酸性:HClO4>H2SO4>H3PO4 B. 半径:Cl—>Na+>F—
C. 热稳定性:HF>HCl>HBr D. 还原性:Cl—<Br—<I—
【答案】B
【解析】A项,非金属性Cl![]() S
S![]() P,最高价氧化物对应水化物酸性HClO4
P,最高价氧化物对应水化物酸性HClO4![]() H2SO4
H2SO4![]() H3PO4;B项,根据“层多径大,序大径小”,半径Cl-
H3PO4;B项,根据“层多径大,序大径小”,半径Cl-![]() F-
F-![]() Na+;C项,非金属性F
Na+;C项,非金属性F![]() Cl
Cl![]() Br,气态氢化物的热稳定性HF
Br,气态氢化物的热稳定性HF![]() HCl
HCl![]() HBr;D项,非金属性Cl
HBr;D项,非金属性Cl![]() Br
Br![]() I,还原性Cl-
I,还原性Cl-![]() Br-
Br-![]() I-。
I-。
A项,Cl、S、P都是第三周期元素,同周期从左到右元素的非金属性逐渐增强,最高价氧化物对应水化物的酸性逐渐增强,非金属性Cl![]() S
S![]() P,最高价氧化物对应水化物酸性HClO4
P,最高价氧化物对应水化物酸性HClO4![]() H2SO4
H2SO4![]() H3PO4,A项正确;B项,根据“层多径大,序大径小”,半径Cl-
H3PO4,A项正确;B项,根据“层多径大,序大径小”,半径Cl-![]() F-
F-![]() Na+,B项错误;C项,F、Cl、Br都是第VIIA族元素,同主族从上到下元素的非金属性逐渐减弱,气体氢化物的稳定性逐渐减弱,非金属性F
Na+,B项错误;C项,F、Cl、Br都是第VIIA族元素,同主族从上到下元素的非金属性逐渐减弱,气体氢化物的稳定性逐渐减弱,非金属性F![]() Cl
Cl![]() Br,气态氢化物的热稳定性HF
Br,气态氢化物的热稳定性HF![]() HCl
HCl![]() HBr,C项正确;D项,Cl、Br、I都是第VIIA族元素,同主族从上到下元素的非金属性逐渐减弱,非金属性Cl
HBr,C项正确;D项,Cl、Br、I都是第VIIA族元素,同主族从上到下元素的非金属性逐渐减弱,非金属性Cl![]() Br
Br![]() I,还原性Cl-
I,还原性Cl-![]() Br-
Br-![]() I-,D项正确;答案选B。
I-,D项正确;答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】甲醇被称为21世纪的新型燃料,研究和合成甲醇有着重要的意义。
(1)已知:①H2(g)+1/2O2(g)![]() H2O(l) ΔH1<0;②CO2(g)
H2O(l) ΔH1<0;②CO2(g)![]() CO(g)+1/2O2(g) ΔH2>0;③甲醇的燃烧热为ΔH3。试用ΔH1、ΔH2、ΔH3表示CO(g)+2H2(g)
CO(g)+1/2O2(g) ΔH2>0;③甲醇的燃烧热为ΔH3。试用ΔH1、ΔH2、ΔH3表示CO(g)+2H2(g)![]() CH3OH(l)的ΔH, 则ΔH=__kJ·mol-1。
CH3OH(l)的ΔH, 则ΔH=__kJ·mol-1。
(2)该方法生产甲醇是目前工业上常用的方法。在一定温度下,向2L密闭容器中充入1mol CO和2mol H2,发生反应CO(g)+2H2(g)![]() CH3OH(g), 5分钟反应达平衡,此时CO的转化率为80%。请回答:
CH3OH(g), 5分钟反应达平衡,此时CO的转化率为80%。请回答:
①下列叙述合确的是__________(填编号)。
A.达到平衡时,移走部分甲醇,平衡将向右移动,正反应速率加快
B.缩小容器的体积,平衡将向右移动,c(CO)将变大
C.在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂
D.若保持平衡时的温度和容积不变,再向容器中充入0.8mol CO和0.6mol CH3OH,则此时v正>v逆
②在方框的坐标系中画出甲醇的物质的量浓度随时间的变化曲线 ___________________
(3)CO2和H2在催化剂Cu/ZnO作用下可发生两个平行反应,分别生成CH3OH和CO。
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
反应Ⅱ: CO2(g)+H2(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
控制CO2和H2初始投料比为1:3时,温度对CO2平衡转化率及甲醇和CO产率的影响如图2所示。
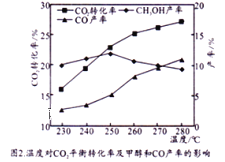
①由图2可知温度升高CO的产率上升,其主要原因可能是__________。
②由图2可知获取CH3OH最适宜的温度是_____。
(4)近几年开发的甲醇燃料电池的工作原理如图所示:
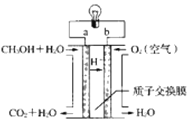
电池中的质子交换膜只允许质子和水分子通过,电解质溶液为稀硫酸,则a电极的电极反应式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组微粒在指定溶液中一定能大量共存的是( )
A.稀硫酸溶液:NH4+、Al3+、Cl-、K+
B.使酚酞变红的溶液:Na+、HSO3-、Cl-、Ba2+
C.FeCl2溶液:H+、NO3-、Ag+、K+
D.无色透明的溶液:H+、Na+、MnO4-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料和燃料,CO、CO2在催化剂的作用下都可以合成甲醇。
Ⅰ. 工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g)+2H2(g)![]() CH3OH(g) ΔH
CH3OH(g) ΔH
(1)判断反应达到平衡状态的依据是___________(填字母)。
A. CH3OH的浓度不再发生变化 B. 生成CH3OH的速率与消耗CO的速率相等
C. 氢气的体积分数保持不变 D. 混合气体的密度不变
(2)为研究平衡时CO的转化率与反应物投料比![]() 及温度的关系,研究小组在10 L的密闭容器中进行模拟反应,并绘出下图。
及温度的关系,研究小组在10 L的密闭容器中进行模拟反应,并绘出下图。
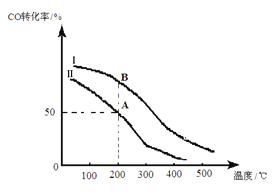
①反应热△H_______0(填“>”或“<”),判断依据是__________________________。
②若其他条件相同,Ⅰ、Ⅱ曲线分别表示投料比不同时的反应过程。
a. 投料比:Ⅰ______Ⅱ(填“>”、“<”或“=”)。
b. 若Ⅱ反应的n(CO)起始=10 mol、 投料比为0.5,A点的平衡常数KA =________,B点的平衡常数KB_______KA (填“>”、“<”或“=”)。
③要提高CO的转化率,可以采取的措施是_______________。(填字母)
a. 升温 b. 加入催化剂
c. 增大压强 d. 加入惰性气体
Ⅱ. 用CO2在催化剂的作用下合成甲醇的反应为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)某密闭容器中充入3 mol氢气和1 mol二氧化碳,测得混合气体中甲醇的体积分数与温度的关系如下图所示。
CH3OH(g)+H2O(g)某密闭容器中充入3 mol氢气和1 mol二氧化碳,测得混合气体中甲醇的体积分数与温度的关系如下图所示。
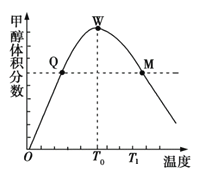
(1)下图中Q点的速率υ正_______υ逆(填“>”、“<”或“=”)。
(2)解释T0~T1内甲醇的体积分数变化趋势的原因_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是新一代饮用水的消毒剂,许多发达国家的自来水厂采用ClO2代替Cl2来进行自来水消毒。我国最近成功研制出制取ClO2的新方法,其反应的微观过程如下图所示:
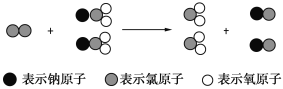
下列有关该反应的叙述中正确的是 ( )
A. 该反应是置换反应
B. 该反应的化学方程式为Cl2+NaClO2===ClO2+NaCl
C. 反应中Cl2既是氧化剂,又是还原剂
D. 氧化性: Cl2 > ClO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列叙述中正确的是( )
A. 常温下,1 L 0.1 mol·L-1 MgCl2溶液中含Mg2+数为0.1NA
B. 常温常压下的33.6 L Cl2与27g Al充分反应,转移电子数为3 NA
C. 1mol单质铁被氧化时一定失去3NA个电子
D. 常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
铂(Pt)及其化合物的用途广泛。
(1)在元素周期表中,铂元素与铁元素同族,则铂元素位于_______。
A.s区 B.p区 C.d区 D.ds 区 E.f区
(2)二氯二吡啶合铂是由Pt2+、Cl-和吡啶结合形成的铂配合物,有顺式和反式两种同分异构体。科学研究表明,反式分子和顺式分子一样具有抗癌活性。
①Cl-的外围电子排布式为_______。
![]()
②吡啶分子是大体积平面配体,其结构简式如右图所示,该配体的配位原子是_____。吡啶分子中,碳、氮原子的轨道杂化方式分别是____、____,各元素的电负性由大到小的顺序为_______。
③二氯二吡啶合铂分子中存在的微粒间作用力有______(填序号)。
a.离子键 b.配位键 c.金属键 d.非极性键 e.氢键
④二氯二吡啶合铂分子中,Pt2+的配位数是4,但是其轨道杂化方式并不是sp3。
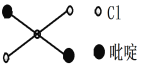
简述理由:_____________________________。
⑤反式二氯二吡啶合铂分子结构如右图所示,该分子
是_______分子(选填“极性”、“非极性”)。
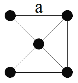
(3)金属铂晶体中,铂原子的配位数为12,其面心立方晶胞沿 x、y或z轴的投影图如右图所示。若金属铂的密度为d g·cm-3,则晶胞参数a=____________nm(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的密闭容器中通入lmol X和2molY,发生如下反应:X(g) + 2Y(g)![]() M(g) + 2N(g) △H=akJ/mol(a>0),下列说法中正确的是:
M(g) + 2N(g) △H=akJ/mol(a>0),下列说法中正确的是:
A. v正(M)=2v逆(N)时,反应到达平衡状态
B. 到达平衡状态时,反应吸收akJ能量
C. 2s 末反应达到平衡时,加入催化剂,反应速率不会发生改变
D. 2s 末反应达到平衡时,Y的消耗量是X的生成量的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验中需用0.2 mol/L的Na2CO3溶液450 mL,配制时应称取Na2CO3固体的质量为_______
(2)下图是某同学用500 mL容量瓶配制0.10 mol·L-1 NaOH溶液的过程:
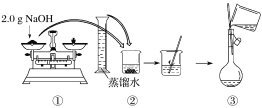

该同学的错误步骤有____________处
(3)配制220 mL 1.0 mol·L-1硫酸溶液:
①所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________(计算结果保留一位小数)mL;
②如果实验室有15 mL、20 mL、50 mL量筒,应选用_______mL量筒最好;
③配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是______________________
(4)在配制4.6 mol/L稀H2SO4的过程中,下列情况对硫酸溶液物质的量浓度有何影响(填“偏高”、“偏低”或“无影响”)?
①容量瓶检漏后未干燥就使用:____________。
②定容时仰视观察液面:_____。
③移液后未洗涤烧杯和玻璃棒:_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com