
【题目】甲醇被称为21世纪的新型燃料,研究和合成甲醇有着重要的意义。
(1)已知:①H2(g)+1/2O2(g)![]() H2O(l) ΔH1<0;②CO2(g)
H2O(l) ΔH1<0;②CO2(g)![]() CO(g)+1/2O2(g) ΔH2>0;③甲醇的燃烧热为ΔH3。试用ΔH1、ΔH2、ΔH3表示CO(g)+2H2(g)
CO(g)+1/2O2(g) ΔH2>0;③甲醇的燃烧热为ΔH3。试用ΔH1、ΔH2、ΔH3表示CO(g)+2H2(g)![]() CH3OH(l)的ΔH, 则ΔH=__kJ·mol-1。
CH3OH(l)的ΔH, 则ΔH=__kJ·mol-1。
(2)该方法生产甲醇是目前工业上常用的方法。在一定温度下,向2L密闭容器中充入1mol CO和2mol H2,发生反应CO(g)+2H2(g)![]() CH3OH(g), 5分钟反应达平衡,此时CO的转化率为80%。请回答:
CH3OH(g), 5分钟反应达平衡,此时CO的转化率为80%。请回答:
①下列叙述合确的是__________(填编号)。
A.达到平衡时,移走部分甲醇,平衡将向右移动,正反应速率加快
B.缩小容器的体积,平衡将向右移动,c(CO)将变大
C.在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂
D.若保持平衡时的温度和容积不变,再向容器中充入0.8mol CO和0.6mol CH3OH,则此时v正>v逆
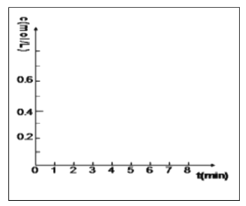
②在方框的坐标系中画出甲醇的物质的量浓度随时间的变化曲线 ___________________
(3)CO2和H2在催化剂Cu/ZnO作用下可发生两个平行反应,分别生成CH3OH和CO。
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
反应Ⅱ: CO2(g)+H2(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
控制CO2和H2初始投料比为1:3时,温度对CO2平衡转化率及甲醇和CO产率的影响如图2所示。
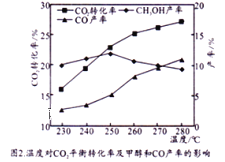
①由图2可知温度升高CO的产率上升,其主要原因可能是__________。
②由图2可知获取CH3OH最适宜的温度是_____。
(4)近几年开发的甲醇燃料电池的工作原理如图所示:
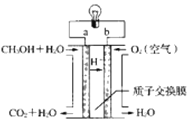
电池中的质子交换膜只允许质子和水分子通过,电解质溶液为稀硫酸,则a电极的电极反应式为____。
【答案】ΔH=2ΔH1-ΔH2-ΔH3BCD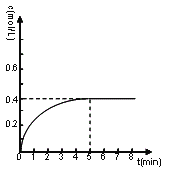 反应Ⅱ正反应是吸热反应,温度升高平衡正向移动,CO产率升高250℃CH3OH+H2O-6e-
反应Ⅱ正反应是吸热反应,温度升高平衡正向移动,CO产率升高250℃CH3OH+H2O-6e-![]() CO2↑+6H+
CO2↑+6H+
【解析】
(1)由已知,③为:CH3OH(l)+![]() O2(g)
O2(g)![]() CO2(g)+2H2O(l) ΔH3,根据盖斯定律,①×2-②-③得:CO(g)+2H2(g)
CO2(g)+2H2O(l) ΔH3,根据盖斯定律,①×2-②-③得:CO(g)+2H2(g)![]() CH3OH(l) ΔH=2ΔH1-ΔH2-ΔH3。
CH3OH(l) ΔH=2ΔH1-ΔH2-ΔH3。
(2)①A项,减小生成物浓度,化学平衡正向移动,正逆反应速率都减小,故A错误;
B项,增大压强,化学平衡向气体分子数减小的方向移动,因为该反应正向气体分子数减小,所以缩小容器的体积,压强变大,平衡将向右移动;体积缩小导致c(CO)变大,根据化学平衡移动原理,达到新平衡时c(CO)仍比原平衡时大,故B正确;
C项,催化剂能同等程度加快正逆反应速率,所以应选用乙催化剂,故C正确;
D项,由已知,5分钟反应达平衡时各物质的浓度为:c(CO)=0.1mol/L、c(H2)=0.2mol/L、c(CH3OH)=0.4mol/L,所以K=![]() =
=![]() =100,若保持平衡时的温度和容积不变,再向容器中充入0.8mol CO和0.6mol CH3OH,此时c(CO)=0.5mol/L、c(H2)=0.2mol/L、c(CH3OH)=0.7mol/L,Q=
=100,若保持平衡时的温度和容积不变,再向容器中充入0.8mol CO和0.6mol CH3OH,此时c(CO)=0.5mol/L、c(H2)=0.2mol/L、c(CH3OH)=0.7mol/L,Q=![]() =
=![]() =35<K,所以此时平衡正向移动,v正>v逆,故D正确。
=35<K,所以此时平衡正向移动,v正>v逆,故D正确。
综上分析,符合题意的选项为BCD。
②由已知,甲醇的初始物质的量浓度为0,5分钟反应达平衡,前面已经算出此时甲醇物质的量浓度为0.4mol/L,所以甲醇的物质的量浓度随时间的变化曲线可用如图表示: 。
。
(3)由图2可得,温度升高,CO2平衡转化率上升、CO的产率上升、温度高于250℃时甲醇的产率降低,则:①反应Ⅱ正反应是吸热反应,温度升高平衡正向移动,CO产率升高;②获取CH3OH最适宜的温度是250℃。
(4)由图可得,a电极原料是CH3OH和水,b电极原料为氧气,电解质溶液为稀硫酸,质子交换膜只允许质子和水分子通过,则a极为电池负极,发生氧化反应生成CO2和H+,电极反应式为:CH3OH+H2O-6e-![]() CO2↑+6H+。
CO2↑+6H+。


科目:高中化学 来源: 题型:
【题目】(化学选修3—有机化学基础)
8羟基喹啉被广泛用作金属离子的络合剂和萃取剂,也是重要的医药中间体。下图是8羟基喹啉的合成路线。
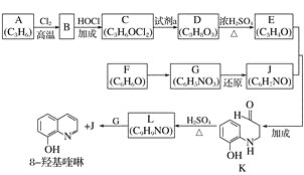
已知:ⅰ.![]()
ⅱ.同一个碳原子上连有2个羟基的分子不稳定。
(1)按官能团分类,A的类别是________________。
(2)A→B的化学方程式是________________。
(3)C可能的结构简式是________________。
(4)C→D所需的试剂a是________________。
(5)D→E的化学方程式是________________。
(6)F→G的反应类型是________________。
(7)将下列K→L的流程图补充完整:
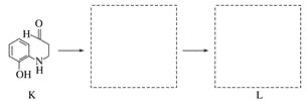 ___________________________
___________________________
(8)合成8羟基喹啉时,L发生了________(填“氧化”或“还原”)反应。反应时还生成了水,则L与G物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
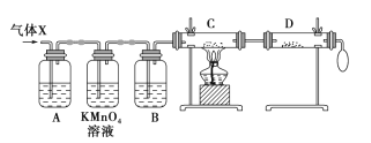
【题目】某课外活动小组的同学在实验室做锌与浓硫酸反应的实验时,甲同学认为产生的气体是二氧化硫;而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两同学的判断是否正确,丙同学设计了如图所示的实验装置(锌与浓硫酸共热时产生的气体为X,且该反应装置已略去):
试回答:
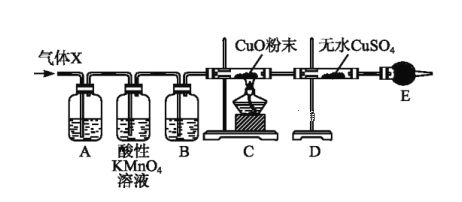
(1)上述实验中生成二氧化硫气体的化学方程式为_________。
(2)乙同学认为还可能产生氢气的理由是__________。
(3)丙同学在安装好装置后,必不可少的一步操作是__________。
(4)B中加入的试剂是______,其作用是___________。
(5)可以证明气体X中含有氢气的实验现象是;C中______,D中______。如果撤去装置B,是否还能根据D中的现象判断气体X中含有氢气?___________
为什么?_______________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+B ![]() 3C+4D反应中,表示该反应速率最快的是
3C+4D反应中,表示该反应速率最快的是
A. v(A)=0.5mol·L-1· s-1B. v(B)=0.3 mol·L-1· s-1
C. v(C)=0.8 mol·L-1· s-1D. v(D)=10 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2 L密闭容器中,X、Y、Z三种气态物质发生化学反应时,物质的量随时间变化的关系曲线如图所示:
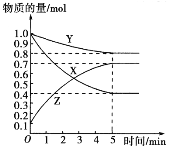
(1)由图中的数据分析,该反应的化学方程式为_________ 。
(2)5 min内用Z表示的平均反应速率为_______________。
(3)化学反应速率受到很多因素的影响,例如:实验室制取氢气时一般用粗锌代替纯锌和稀硫酸反应,这是利用_____________________原理加快了氢气生成的速率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】动物油和植物油的不同之处是( )
A. 前者给人体提供的热量多,后者给人体提供的热量少
B. 前者是高分子化合物,后者不是
C. 前者的烃基是较饱和的,后者的烃基是较不饱和的
D. 前者能水解,后者不能水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌与浓硫酸反应,随着硫酸的浓度下降,产生的气体中混有H2,为证实相关分析,化学小组的同学设计了如图所示的实验装置,对反应后的气体(X)取样进行组分分析(遇有气体吸收过程,视为完全吸收)。
(1)A中加入的试剂可能是_________,若高锰酸钾溶液与B 之间不再添加装置,请描述观察到何种现象能表明已达到使用高锰酸钾溶液的目的_______________。
(2)可证实气体 X 中混有较多氢气的实验现象是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验内容、实验装置和对应的实验目的均正确的是
A. 测定中和热 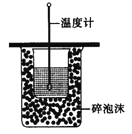
B. 比较Cu2+、Fe3+对反应速率的影响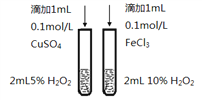
C. 比较醋酸和硼酸的酸性强弱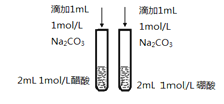
D. 比较温度对化学反应速率的影响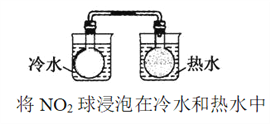
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列性质递变不正确的是( )
A. 酸性:HClO4>H2SO4>H3PO4 B. 半径:Cl—>Na+>F—
C. 热稳定性:HF>HCl>HBr D. 还原性:Cl—<Br—<I—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com