
【题目】在恒温恒容的密闭容器中通入lmol X和2molY,发生如下反应:X(g) + 2Y(g)![]() M(g) + 2N(g) △H=akJ/mol(a>0),下列说法中正确的是:
M(g) + 2N(g) △H=akJ/mol(a>0),下列说法中正确的是:
A. v正(M)=2v逆(N)时,反应到达平衡状态
B. 到达平衡状态时,反应吸收akJ能量
C. 2s 末反应达到平衡时,加入催化剂,反应速率不会发生改变
D. 2s 末反应达到平衡时,Y的消耗量是X的生成量的2倍
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关实验内容、实验装置和对应的实验目的均正确的是
A. 测定中和热 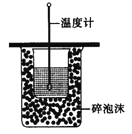
B. 比较Cu2+、Fe3+对反应速率的影响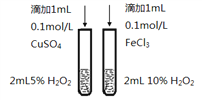
C. 比较醋酸和硼酸的酸性强弱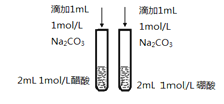
D. 比较温度对化学反应速率的影响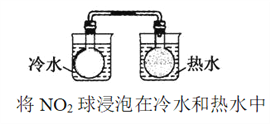
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列性质递变不正确的是( )
A. 酸性:HClO4>H2SO4>H3PO4 B. 半径:Cl—>Na+>F—
C. 热稳定性:HF>HCl>HBr D. 还原性:Cl—<Br—<I—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用Na2SO4溶液沉淀Ba2+、Pb2+、Ca2+三种金属离子(M2+),所需SO42-最低浓度的对数值p(SO42-)=-lgc(SO42-)与p(M2+)=-lgc(M2+)关系如图所示。下列说法正确的是

A. KSP(CaSO4)<KSP(PbSO4)<KSP(BaSO4)
B. a点可表示CaSO4的饱和溶液,且c(Ca2+)=c(SO42-)
C. b点可表示PbSO4的不饱和溶液,且c(Pb2+)<c(SO42-)
D. 向Ba2+浓度为10-5mol·L-1的废水中加入CaSO4粉末,会有BaSO4沉淀析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列9种微粒:①NH2-②-NH2;③Br-;④OH-;⑤-NO2; ⑥-OH;⑦NO2;⑧CH3+;⑨-CH3中,属于官能团的有(填序号)____________;能跟C2H5+结合生成有机物分子的微粒有(填序号)____________。
(2)根据烯、炔烃的命名原则,回答下列问题:
①CH≡CC(CH3)3的名称是__________________。
②写出2-甲基-2-戊烯的结构简式________________________。
(3)现有分子式为C4H10O的有机物,同分异构体中属于醇的共有_______________种,其中能被氧化为醛的有____________种,能被氧化为酮的有__________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下有:①6.72LCH4,②3.01×1023个HCl分子,③13.6gH2S,④0.2molNH3。下列对这四种气体的描述正确的是( )
a. 体积②>③>①>④ b. 密度②>③>④>①
c. 质量②>③>①>④ d. 氢原子个数①>③>④>②
A. abc B. bcd C. abd D. abcd
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下3.2g CO与CO2的混合气体,体积为2.24L。则:混合气体的平均摩尔质量是________ CO2和CO的体积之比是________ CO2和CO的质量之比是_______,混合气体中所含氧原子的物质的量是_______
(2)若10 g密度为ρ g·cm-3的Ca(NO3)2溶液中含有4 g Ca2+,则溶液中NO3-的物质的量浓度为____________
(3)在标准状况下,将V L A气体(摩尔质量为M g·mol-1)溶于0.1 L水中,所得溶液的密度为ρ g·cm-3,则此溶液的物质的量浓度(mol·L-1)为 ____________________
(4)在反应3BrF3+5H2O===9HF+Br2+HBrO3+O2↑中,若有2molH2O参加反应,有_____mol水作还原剂,被水还原的溴元素____________mol;
(5)把V L含MgSO4和K2SO4的混合溶液分成五等份,一份加入含a mol NaOH的溶液恰好使镁离子完全沉淀;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为_______
(6)3.04g铜镁合金完全溶解于50mL密度为1.40g·mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体2240mL(标准状况),向反应后的溶液中加入1.0mol·L-1NaOH溶液,当金属离子全部沉淀时,得到5.08g沉淀,则该浓硝酸中HNO3的物质的量浓度是 ___mol·L-1,镁的质量为______g,NO2和N2O4的混合气体中,NO2的体积分数是___,得到5.08g沉淀时,加入NaOH溶液的体积是____mL。
(7)在100mL FeBr2溶液中通入2.24L Cl2(标准状况),溶液中有1/3的溴元素被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中作正极的是__________________ (填“A”或“B”) ;
(2)装置乙溶液中C电极反应:__________________________________;装置乙中反应一段时间后,测得C电极 的质量增加12.8克,则该电池反应转移电子的物质的量为___________mol
(3)装置丙中金属A上电极反应属于______________(填“氧化反应”或“还原反应”);
(4)四种金属活动性由强到弱的顺序是_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com