
【题目】[化学——选修3:物质结构与性质]
铂(Pt)及其化合物的用途广泛。
(1)在元素周期表中,铂元素与铁元素同族,则铂元素位于_______。
A.s区 B.p区 C.d区 D.ds 区 E.f区
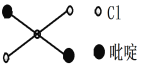
(2)二氯二吡啶合铂是由Pt2+、Cl-和吡啶结合形成的铂配合物,有顺式和反式两种同分异构体。科学研究表明,反式分子和顺式分子一样具有抗癌活性。
①Cl-的外围电子排布式为_______。
![]()
②吡啶分子是大体积平面配体,其结构简式如右图所示,该配体的配位原子是_____。吡啶分子中,碳、氮原子的轨道杂化方式分别是____、____,各元素的电负性由大到小的顺序为_______。
③二氯二吡啶合铂分子中存在的微粒间作用力有______(填序号)。
a.离子键 b.配位键 c.金属键 d.非极性键 e.氢键
④二氯二吡啶合铂分子中,Pt2+的配位数是4,但是其轨道杂化方式并不是sp3。
简述理由:_____________________________。
⑤反式二氯二吡啶合铂分子结构如右图所示,该分子
是_______分子(选填“极性”、“非极性”)。
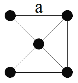
(3)金属铂晶体中,铂原子的配位数为12,其面心立方晶胞沿 x、y或z轴的投影图如右图所示。若金属铂的密度为d g·cm-3,则晶胞参数a=____________nm(列出计算式即可)。
【答案】C3s23p6Nsp2 、sp2N、C、Hb、d若Pt2+以sp3杂化轨道进行配位,则二氯二吡啶合铂为四面体结构, 不存在顺反异构体非极性![]() 或
或![]()
【解析】
(1)在元素周期表中,铂元素与铁元素同族,铁元素位于元素周期表的d区,所以铂元素也位于d区,故答案选C;正确选项C。
(2)①Cl-核外有18个电子,其外围电子排布式为:3s23p6;正确答案: 3s23p6。
②在吡啶分子中,由N原子提供孤电子对形成配体,所以该配体的配位原子是N原子,在吡啶分子中,碳原子形成2个单键和1个双键,共3个σ键,氮原子形成1个单键、1个双键和1个配位键,共3个σ键,所以碳、氮原子的轨道杂化方式分别是sp2、sp2,吡啶由N、C、H三种元素组成,因非金属性N>C>H,所以电负性由大到小的顺序为:N、C、H;正确答案:N;sp2;sp2;N、C、H。
③二氯二吡啶合铂分子是由Pt2+、Cl-和吡啶结合形成的铂配合物,所以存在配位键,碳原子之间形成非极性键,因二氯二吡啶合铂属于分子,所以不存在离子键和金属键,又因氮原子未连接氢原子,所以不存在氢键,故答案为:b、d。
④二氯二吡啶合铂有顺式和反式两种同分异构体,在二氯二吡啶合铂分子中,若Pt2+以sp3杂化轨道进行配位,则二氯二吡啶合铂为四面体结构,不存在顺反异构体,所以Pt2+的配位数虽然是4,但是其轨道杂化方式并不是sp3;正确答案:若Pt2+以sp3杂化轨道进行配位,则二氯二吡啶合铂为四面体结构,不存在顺反异构体。
⑤吡啶分子是大体积平面配体,由反式二氯二吡啶合铂分子的结构示意图可知,该分子的结构是一种对称结构,所以反式二氯二吡啶合铂分子是非极性分子;正确答案:非极性;
(3)由金属铂立方晶胞的投影示意图可知,金属铂是面心立方最密堆积结构,则一个晶胞中含有8×1/8+6×1/2=4个Pt原子,则金属铂的密度d g、cm-3=[4×195/NA]/(a×10-7)3,a=![]() ;正确答案:
;正确答案: ![]() 或
或![]() 。
。


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】锌与浓硫酸反应,随着硫酸的浓度下降,产生的气体中混有H2,为证实相关分析,化学小组的同学设计了如图所示的实验装置,对反应后的气体(X)取样进行组分分析(遇有气体吸收过程,视为完全吸收)。
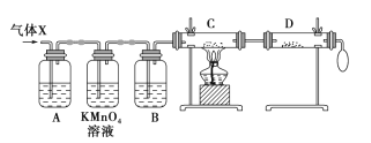
(1)A中加入的试剂可能是_________,若高锰酸钾溶液与B 之间不再添加装置,请描述观察到何种现象能表明已达到使用高锰酸钾溶液的目的_______________。
(2)可证实气体 X 中混有较多氢气的实验现象是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钙的冶炼方法是电解法,这一事实说明了( )
A. 金属钙离子易得电子变成金属钙原子B. 金属钙是不活泼的金属元素
C. 金属钙原子易失去电子变成钙离子D. 金属钙离子的氧化性很强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列性质递变不正确的是( )
A. 酸性:HClO4>H2SO4>H3PO4 B. 半径:Cl—>Na+>F—
C. 热稳定性:HF>HCl>HBr D. 还原性:Cl—<Br—<I—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】总的物质的量为0.50mol的Fe粉与Al粉混合物分为等质量的两份;在一份中加入足量的稀盐酸,在标准状况下产生气体aL;在另一份中加入足量的氢氧化钠溶液,在标准状况下产生气体bL。则a+b的数值不可能是( )
A. 5.6 B. 7.3 C. 8.2 D. 11.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用Na2SO4溶液沉淀Ba2+、Pb2+、Ca2+三种金属离子(M2+),所需SO42-最低浓度的对数值p(SO42-)=-lgc(SO42-)与p(M2+)=-lgc(M2+)关系如图所示。下列说法正确的是

A. KSP(CaSO4)<KSP(PbSO4)<KSP(BaSO4)
B. a点可表示CaSO4的饱和溶液,且c(Ca2+)=c(SO42-)
C. b点可表示PbSO4的不饱和溶液,且c(Pb2+)<c(SO42-)
D. 向Ba2+浓度为10-5mol·L-1的废水中加入CaSO4粉末,会有BaSO4沉淀析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下有:①6.72LCH4,②3.01×1023个HCl分子,③13.6gH2S,④0.2molNH3。下列对这四种气体的描述正确的是( )
a. 体积②>③>①>④ b. 密度②>③>④>①
c. 质量②>③>①>④ d. 氢原子个数①>③>④>②
A. abc B. bcd C. abd D. abcd
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷与氧可发生如下反应:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P:akJmol-1、P-O:bkJmol-1、P=O:ckJmol-1、O=O:dkJmol-1.根据图示的分子结构和有关数据估算1mol白磷反应放出的热量,其中正确的是
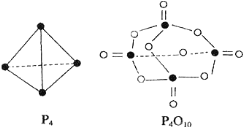
A. (6a+5d-4c-12b)kjB. (4c+12b-6a-5d)kJ
C. (4c+12b-4a-5d)kJD. (4a+5d-4c-12b)kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com