
����Ŀ��25 ��ʱ���������ʵĵ��볣�����±���ʾ��
��ѧʽ | CH3COOH | H2C2O4 | H2S |
���볣�� | 1.8��10��5 | Ka1��5.4��10��2 Ka2��5.4��10��5 | Ka1��1.0��10��7 Ka2��7.1��10��15 |
��ش��������⣺
��1������CH3COOH��H2C2O4��HC2O4-��H2S��HS- ����������,����������������________��
��2��CH3COOH��H2C2O4��H2S��������ǿ������˳��Ϊ_____________________��
��3��NaHS��Һ��NaHC2O4��Һ��Ӧ�����ӷ���ʽΪ_______________��
��4��0.1 mol��L��1H2S��Һ��c(H+)=________ mol��L��1��
���𰸡�HS- H2C2O4>CH3COOH>H2S HS����HC2O![]() ===H2S����C2O
===H2S����C2O![]() 1.0��10��4
1.0��10��4
��������
ͬһ�¶��£���ĵ��볣��Խ��������Խǿ��������ĵ��볣��֪������������ǿ��˳���ǣ�H2C2O4��CH3COOH��HC2O4-��H2S��HS-������ǿ���Ʊ�����Ĺ��ɷ���NaHS��Һ��NaHC2O4��Ӧ�IJ������H2S�ĵ���ƽ�ⳣ�����м��㣨�Ե�һ��Ϊ������
��1��ͬһ�¶��£���ĵ��볣��Խ��������Խǿ��������ĵ��볣��֪������������ǿ��˳���ǣ�H2C2O4��CH3COOH��HC2O4-��H2S��HS-������������ǿ����H2C2O4����������HS-��
�ʴ��ǣ�HS- ��
��2��ͬһ�¶��£���ĵ��볣��Խ��������Խǿ��������ĵ��볣��֪������������ǿ��˳���ǣ�H2C2O4��CH3COOH��HC2O4-��H2S��HS-������CH3COOH��H2C2O4��H2S��������ǿ������˳��ΪH2C2O4��CH3COOH��H2S��
�ʴ��ǣ�H2C2O4>CH3COOH>H2S��
��3����������HC2O4-��H2S��HS-������NaHS��Һ��NaHC2O4��Һ��Ӧ����H2S��C2O![]() �����ӷ���ʽΪ��HS����HC2O
�����ӷ���ʽΪ��HS����HC2O![]() ===H2S����C2O
===H2S����C2O![]() ��
��
�ʴ��ǣ�HS����HC2O![]() ===H2S����C2O
===H2S����C2O![]() ��
��
��4��H2S�������ᣬ����̶Ƚ�С���Ե�һ������Ϊ���� ��֪H2S![]() HS-+H+��Ka1��1.0��10��7����0.1 mol��L��1H2S��Һ�У�������Ũ��C(H+)=x mol��L��1������ݵ���ƽ�ⳣ����֪��Ka1= C(H+) C(HS-)/c��H2S��������C(H+) ��C(HS-)�����ԣ�C2(H+)/0.1=1.0��10��7��C(H+)=10-4 mol��L��1��
HS-+H+��Ka1��1.0��10��7����0.1 mol��L��1H2S��Һ�У�������Ũ��C(H+)=x mol��L��1������ݵ���ƽ�ⳣ����֪��Ka1= C(H+) C(HS-)/c��H2S��������C(H+) ��C(HS-)�����ԣ�C2(H+)/0.1=1.0��10��7��C(H+)=10-4 mol��L��1��
�ʴ��ǣ�1.0��10��4��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����98����Ũ����(�ܶ�Ϊ1.84 g/cm3 )����100 mL l mol/L��ϡ���ᡣ�ָ�����������(���ƹ����п����õ�)����100 mL��Ͳ ��10 mL��Ͳ ��50 mL�ձ� ��������ƽ ��100 mL����ƿ ��ͷ�ι� �߲���������ʹ���������Ⱥ�˳��������ȷ����.( )
A.�ܢۢߢݢޣ�B.�ڢݢߢޣ�C.�٢ۢݢޢߣ�D.�ڢޢۢߢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ϸ��ˮƽ������Ч��������״�����ĸ�Ⱦ���������(H)��������һ���������Ƶã�����һ�ֺϳɷ������£�
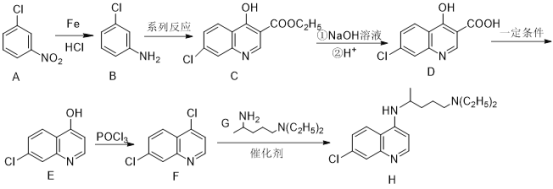
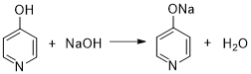
��֪��
�ص��������⣺
(1)A�к��еĹ���������Ϊ_____________��
(2)B�ķ���ʽΪ_____________��
(3)̼ԭ��������4����ͬ��ԭ�ӻ����ʱ����̼ԭ�ӳ�Ϊ����̼ԭ�ӣ�H����_________������̼ԭ�ӡ�
(4)F��H�ķ�Ӧ����Ϊ_____________��
(5)C��NaOH��Һ��Ӧ�Ļ�ѧ����ʽΪ___________________________________________��
(6)E��������Ӧ��IJ���M�ķ���ʽΪC9H8NOCl����������������M��__________�֡�
����FeCl3��Һ������ɫ��Ӧ �ڳ������ⲻ��������״�ṹ
�۱�����ֻ��2��ȡ���� �ܺ��У�NH2��![]()
���к˴Ź���������5��壬�ҷ����֮��Ϊ1��2��2��1��2��M�Ľṹ��ʽΪ___________��(��д2��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������´��ڷ�Ӧ��CO(g)��H2O(g)![]() CO2(g)��H2(g)��������Ӧ���ȡ�����������ͬ��2 L���ݾ���(�����û����������)�ܱ��������ڢ��г���1 mol CO��1 mol H2O���ڢ��г���1 mol CO2��1 mol H2���ڢ��г���2 mol CO��2 mol H2O,700 �������¿�ʼ��Ӧ���ﵽƽ��ʱ������˵����ȷ����(����)
CO2(g)��H2(g)��������Ӧ���ȡ�����������ͬ��2 L���ݾ���(�����û����������)�ܱ��������ڢ��г���1 mol CO��1 mol H2O���ڢ��г���1 mol CO2��1 mol H2���ڢ��г���2 mol CO��2 mol H2O,700 �������¿�ʼ��Ӧ���ﵽƽ��ʱ������˵����ȷ����(����)
A.����������������Ӧ������ͬB.�����������з�Ӧ��ƽ�ⳣ����ͬ
C.��������CO�����ʵ������������е���D.��������CO��ת��������������CO2��ת����֮��С��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����ĩ������![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() �е�һ�ֻ�����ɡ����÷�ĩ�����������ᷴӦ������
�е�һ�ֻ�����ɡ����÷�ĩ�����������ᷴӦ������![]() �ݳ���
�ݳ���![]() ͨ��������
ͨ��������![]() ��Һ�������С��ͬ�¡�ͬѹ�²ⶨ��������ԭ����Ϸ�ĩ�ڿ������þƾ��Ƽ��ȣ�Ҳ������ų�����ʣ��������������ԭ��Ϸ�ĩ�������������ж���ȷ����
��Һ�������С��ͬ�¡�ͬѹ�²ⶨ��������ԭ����Ϸ�ĩ�ڿ������þƾ��Ƽ��ȣ�Ҳ������ų�����ʣ��������������ԭ��Ϸ�ĩ�������������ж���ȷ����
�ٷ�ĩ��һ����![]() ��
��![]() ��
��![]() �� �ڷ�ĩ��һ������
�� �ڷ�ĩ��һ������![]() ��
��![]()
�۷�ĩ��һ��������![]() ��
��![]() �����϶���ĩ���Ƿ���
�����϶���ĩ���Ƿ���![]() ��
��![]()
A.�٢�B.�ڢ�C.�ۢ�D.�٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������������ڽ�������Ӧ���Ʊ�SnCl4��ij��ѧС���ͬѧ���������ʵ��װ�ý����Ʊ���
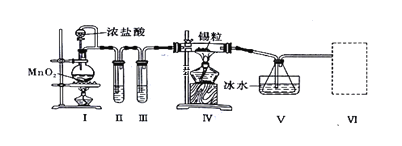
��֪�����������۵�Ϊ231������ѧ�������������ƣ���SnCl4�ķе�Ϊ114������SnCl4����ˮ��Ӧ��
�������ͼװ�ûش�:
��1��װ��I�з�Ӧ�����ӷ���ʽ��________________________________________
��2���Թ�II�е��Լ���________���Թ�III�е��Լ���____________��
��3��װ��V��������____________��
��4���b���� ���ѡ������װ���е�________(����)��
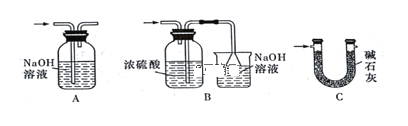
��5��ʵ�����������������װ������δ��Ӧ���MnO2����Ҫ�IJ���������_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʵ���ҽ��а�����ˮ����Ȫʵ��װ��,������������ȷ����(����)
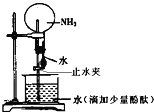
A.��ʵ��˵��������һ�ּ�������ˮ������
B.����Բ����ƿ�е�Һ����ɫ����ɫ��Ϊ��ɫ,˵����ˮ�ʼ���
C.�γ���Ȫ��ԭ���ǰ�������ˮ��,Բ����ƿ�ڵ���ѹС��������ѹ
D.���������氱��,���ô�װ��Ҳ�ɽ�����Ȫʵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪25�� Cʱ����Ԫ��H2X�ĵ���ƽ�ⳣ��K1=5.0��10-2��K2=5.4��10-5�����¶�����AgNO3��Һ�ֱ�ζ�Ũ�Ⱦ�Ϊ0.01mol��L-1��KY��K2X��Һ�����õij�����AgY��Ag2X���ܽ�ƽ��ͼ����ͼ��ʾ������������ȷ����
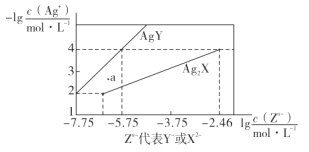
A.25��Cʱ��KHX����ҺpH>7
B.��ӦAg2X+2Y- 2AgY+ X2-��ƽ�ⳣ��Ϊ103.29
C.a��ȿ��Ա�ʾAgY�IJ�������ҺҲ���Ա�ʾAg2X�Ĺ�������Һ
D.��c(Y-)=c(X2-)=0.01 mol��L-1�Ļ��Һ�е���AgNO3��Һʱ��������AgY����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȡ���̿�ʯ����Ҫ�ɷ�Ϊ![]() ��
��![]() ������Ũ���ᷢ�����·�Ӧ�����ʲ����뷴Ӧ��
������Ũ���ᷢ�����·�Ӧ�����ʲ����뷴Ӧ��![]() ���Ƶ�
���Ƶ�![]() ����״�����������й�˵���в���ȷ���ǣ� ��
����״�����������й�˵���в���ȷ���ǣ� ��
A. �������̿�ʯ��![]() ����������Ϊ
����������Ϊ![]()
B. ��������![]() �����ʵ���Ϊ
�����ʵ���Ϊ![]()
C. �μӷ�Ӧ��![]() ������Ϊ
������Ϊ![]()
D. ����ԭ��![]() �����ʵ���Ϊ
�����ʵ���Ϊ![]()
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com