
【题目】某制碱厂的生产流程示意图如下:

下列分析正确的是( )
A. 该制碱法是侯氏制碱法 B. 反应①中包含复分解反应
C. X中只含有Ca2+和Cl— D. 理论上,生产过程中无需补充CO2
【答案】B
【解析】
侯氏制碱法又称联合制碱法,以食盐、氨和二氧化碳(其中二氧化碳来自合成氨厂用水煤气制取氢气时的废气)为原料来制取纯碱,副产物是氯化铵,氯化钠,二氧化碳可以循环使用,降低了成本。
A项、由流程可知,该制碱法以食盐、二氧化碳、氨气、氢氧化钙为原料来制取纯碱,副产物为氯化钙,该制碱法不是侯氏制碱法,故A错误;
B项、反应①为NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓,反应中没有元素发生化合价改变,属于非氧化还原反应,包含复分解反应,故B正确;
C项、母液的主要成分是氯化铵,向母液中加入过量氢氧化钙,氯化铵与氢氧化钙反应生成氨气和氯化钙,X中还可能含有OH—,故C错误;
D项、通入的二氧化碳反应生成碳酸氢钠,碳酸氢钠分解生成碳酸钠、二氧化碳和水,生产过程中需补充二氧化碳,故D错误。
故选B。


 作业辅导系列答案
作业辅导系列答案科目:高中化学 来源: 题型:
【题目】(1)碳酸:H2CO3,Ki1=4.3×10-7,Ki2=5.6×10-11
草酸:H2C2O4,Ki1=5.9×10-2,Ki2=6.4×10-5
①0.1 mol/L Na2CO3溶液的pH____________0.1 mol/L Na2C2O4溶液的pH。(选填“大于”“小于”或“等于”)
②若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是_____。(选填编号)
A.[H+]>[HC2O4-]>[HCO3-]>[CO32-] B.[HCO3-]>[HC2O4-]>[C2O42-]>[CO32-]
C.[H+]>[HC2O4-]>[C2O42-]>[CO32-] D.[H2CO3] >[HCO3-]>[HC2O4-]>[CO32-]
(2)白磷与氧气可发生如下反应:P4+5O2= P4O10。已知断裂下列化学键需要吸收的能量分别为: P—P a kJ·mol-1、P—O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。根据图示的分子结构和有关数据估算该反应的ΔH=___________。

(3)25 ℃,某浓度的盐酸、氯化铵溶液中由水电离出的氢离子浓度分别为1.0×10-amol·L-1、1.0×10-b mol·L-1,这两种溶液的pH之和=___________。
(4)在t ℃时,某Ba(OH)2的稀溶液中c(H+)=10-a mol/L,c(OH-)=10-b mol/L,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸,测得混合溶液的部分pH如下表所示:
序号 | 氢氧化钡溶液 的体积/mL | 盐酸的体积/mL | 溶液的pH |
① | 22.00 | 0.00 | 8 |
② | 22.00 | 18.00 | 7 |
③ | 22.00 | 22.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则c=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 2.24L乙烷中含有的共价键数为0.7NA
B. 23 g钠在空气中充分燃烧生成过氧化钠时氧气得电子数为2NA
C. 11g超重水(3H216O)中含有的中子数为6NA
D. 0.1molN2与0.3molH2在一定条件下充分反应后,生成NH3分子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mLFeBr2溶液中通入标况下氯气3.36L,氯气全部被还原,测得溶液c(Br-)=c(Cl-),原溶液中FeBr2溶液的浓度(mol·L-1)
A. 1 B. 1.5 C. 2 D. 2.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ksp[Mg(OH)2]=1.1×10-11, Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12,下列叙述不正确的是( )
A. 浓度均为2×10-5mol/L的AgNO3溶液和NaCl溶液等体积混合,有白色沉淀生成
B. 将0.001mol/L的AgNO3溶液滴入浓度均为0.001mol/L的KCl和K2CrO4混合溶液中,先产生AgCl沉淀
C. c(Mg2+)为0.11mol/L的溶液中要产生Mg(OH)2沉淀,溶液的pH要控制在9以上
D. 其他条件不变时,向饱和Ag2CrO4水溶液中加入少量K2CrO4固体,溶液中c(Ag+)减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理在科研和生产中有广泛应用。
(1)用生物质热解气(主要成分为CO、CH4、H2)将SO2在一定条件下还原为单质硫进行烟气脱硫。已知:
①C(s)+O2(g)=CO2(g) △H1=-393.5 kJ·mol-1
②CO2(g)+C(s)=2CO(g) △H2= + 172.5 kJ·mol-1
③S(s)+O2(g)=SO2(g) △H3=- 296.0 kJ·mol-1
CO将SO2还原为单质硫的热化学方程式为________________________。
(2)CO可用于合成甲醇,一定温度下,向体积为2 L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),5分钟后达到平衡测得各组分物质的量如下:
CH3OH(g),5分钟后达到平衡测得各组分物质的量如下:
物质 | CO | H2 | CH3OH |
物质的量(mol) | 1.8 | 2.0 | 1.2 |
①反应达到平衡时,CO的转化率为_______,5分钟内用H2表示的速率为________
②该反应的平衡常数K=__________。
③恒温恒容条件下,可以说明反应已达到平衡状态的是__________(填标号)。
A.v正(CO)=2v逆(H2) B.混合气体的密度不变
C.混合气体的平均相对分子质量不变 D.CO、H2的浓度之比为1:2
E.单位时间内,每生成1mol H2消耗2mol CH3OH
④若将容器体积压缩到1L,则达到新平衡时c(H2)的取值范围是_____________。
⑤若保持容器体积不变,再充入0.6 mol CO 和0.4 mol CH3OH,此时v正 __________v逆(填“ >” < ”或“= ”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述正确的是
A. 试剂X可以是氢氧化钠溶液,也可以是盐酸
B. 反应①、过滤后所得沉淀为氢氧化铁
C. 图中所示转化反应都不是氧化还原反应
D. 反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2![]() 2Cl2+2H2O
2Cl2+2H2O
已知:I.反应A中,4molHCl被氧化,放出115.6kJ热量。
II.
判断下列说法正确的是( )
A. 反应A的△H>-115.6kJ·mol-1
B. H2O中H—O键比HCl中H—Cl键弱
C. 由II中的数据判断氯元素的非金属性比氧元素强
D. 断开1molH—O键与断开1molH—Cl键所需能量相差31.9kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A.金刚石、B.MgF2、C.NH4Cl、D.NaNO3、E.干冰、F.固体碘,填写下列空白。(用序号填写)
(1)熔化时不需破坏化学键的是________,熔化时只需破坏共价键的是________,熔点最低的是________,
晶体中既存在离子键又存在共价键的是________。
(2)意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1 mol N—N键吸收167 kJ热量,生成1 mol N≡N键放出942 kJ热量。根据以上信息和数据,则1 mol N4生成N2的ΔH=______ kJ·mol-1
(3) 50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的NaOH溶液在如图所示的装置中进行中和反应。
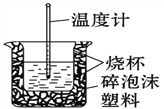
请回答下列问题:
从实验装置上看,图中尚缺少的一种玻璃仪器是_____,烧杯间填满碎泡沫塑料的作用是______。大烧杯上如不盖硬纸板,则求得的中和热数值_______(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com