
【题目】化学反应原理在科研和生产中有广泛应用。
(1)用生物质热解气(主要成分为CO、CH4、H2)将SO2在一定条件下还原为单质硫进行烟气脱硫。已知:
①C(s)+O2(g)=CO2(g) △H1=-393.5 kJ·mol-1
②CO2(g)+C(s)=2CO(g) △H2= + 172.5 kJ·mol-1
③S(s)+O2(g)=SO2(g) △H3=- 296.0 kJ·mol-1
CO将SO2还原为单质硫的热化学方程式为________________________。
(2)CO可用于合成甲醇,一定温度下,向体积为2 L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),5分钟后达到平衡测得各组分物质的量如下:
CH3OH(g),5分钟后达到平衡测得各组分物质的量如下:
物质 | CO | H2 | CH3OH |
物质的量(mol) | 1.8 | 2.0 | 1.2 |
①反应达到平衡时,CO的转化率为_______,5分钟内用H2表示的速率为________
②该反应的平衡常数K=__________。
③恒温恒容条件下,可以说明反应已达到平衡状态的是__________(填标号)。
A.v正(CO)=2v逆(H2) B.混合气体的密度不变
C.混合气体的平均相对分子质量不变 D.CO、H2的浓度之比为1:2
E.单位时间内,每生成1mol H2消耗2mol CH3OH
④若将容器体积压缩到1L,则达到新平衡时c(H2)的取值范围是_____________。
⑤若保持容器体积不变,再充入0.6 mol CO 和0.4 mol CH3OH,此时v正 __________v逆(填“ >” < ”或“= ”)。
【答案】 2CO(g)+SO2(g)=S(s)+2CO2(g) △H=-270 kJ·mol-1 40% 0.24mol/(L·min) 2/3或0.67 C 1mol·L- 1<c(H2)<2mol·L-1 =
【解析】(1)①C(s)+O2(g)=CO2(g) △H1=-393.5 kJ·mol-1,②CO2(g)+C(s)=2CO(g) △H2= + 172.5 kJ·mol-1,③S(s)+O2(g)=SO2(g) △H3=- 296.0 kJ·mol-1,由盖斯定律:①-②-③,2CO(g)+SO2(g)=S(s)+2CO2(g) △H=-270 kJ·mol-1;
(2) CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
c始 1.5 2.2
c变 0.6 1.2 0.6
c平 0.9 1.0 0.6
①反应达到平衡时,CO的转化率为0.6/1.5×100%=40%;5分钟内用H2表示的速率为1.2mol·L-1/5min=0.24mol/(L·min);②该反应的平衡常数K=![]() =
=![]() =2/3或0.67。③恒温恒容条件下,可以说明反应已达到平衡状态的是A、v正(CO)=v逆(H2)/2时处于平衡状态,故A错误;B、反应前后都是气体质量和容器的体积始终不变,混合气体的密度不变,无法证明是否达到平衡,故B错误;C、混合气体的平均相对分子质量=质量/总物质的量,只要平衡一移动,混合气体的物质的量就改变,混合气体的平均相对分子质量不变,说明达到平衡,故C正确;D、CO、H2的浓度之比始终保持为1:2,不能说明达到平衡,故D错误;E、单位时间内,每生成1mol H2消耗2mol CH3OH,速率比不等于方程式的计量数比,故E错误;故选C。④若将容器体积压缩到1L,如若平衡不移动c(H2)的最大值为,则达到新平衡时c(H2)的取值范围是2mol·L-1,加压后平衡正向移动,氢气的浓度减小,小于2mol·L-1,但比1mol·L-1大,即1mol·L- 1<c(H2)<2mol·L-1;⑤若保持容器体积不变,再充入0.6 mol CO 和0.4 mol CH3OH,Qc=
=2/3或0.67。③恒温恒容条件下,可以说明反应已达到平衡状态的是A、v正(CO)=v逆(H2)/2时处于平衡状态,故A错误;B、反应前后都是气体质量和容器的体积始终不变,混合气体的密度不变,无法证明是否达到平衡,故B错误;C、混合气体的平均相对分子质量=质量/总物质的量,只要平衡一移动,混合气体的物质的量就改变,混合气体的平均相对分子质量不变,说明达到平衡,故C正确;D、CO、H2的浓度之比始终保持为1:2,不能说明达到平衡,故D错误;E、单位时间内,每生成1mol H2消耗2mol CH3OH,速率比不等于方程式的计量数比,故E错误;故选C。④若将容器体积压缩到1L,如若平衡不移动c(H2)的最大值为,则达到新平衡时c(H2)的取值范围是2mol·L-1,加压后平衡正向移动,氢气的浓度减小,小于2mol·L-1,但比1mol·L-1大,即1mol·L- 1<c(H2)<2mol·L-1;⑤若保持容器体积不变,再充入0.6 mol CO 和0.4 mol CH3OH,Qc=![]() = 2/3或0.67=K,平衡不移动v正 =v逆。
= 2/3或0.67=K,平衡不移动v正 =v逆。


科目:高中化学 来源: 题型:
【题目】钨(74W)是熔点最高的金属,是重要的战略物资。自然界中钨矿石的主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含少量Si、P、As的化合物。由黑钨矿冶炼钨的工艺流程如下:

已知:①滤渣I的主要成份是Fe2O3、MnO2。②上述流程中,除最后一步外,其余步骤钨的化合价未变。③常温下钨酸难溶于水。 回答下列问题:
(1)钨酸中钨元素的化合价为_________,写出MnWO4在熔融条件下发生碱分解反应生成MnO2的化学方程式___________________________________________。
(2)上述流程中向粗钨酸钠溶液中加硫酸调pH=10后,溶液中的杂质阴离子为SiO32-、HAsO32-、HAsO42-、HPO42-等,则“净化”过程中,加入H2O2时发生反应的离子方程式为_______________________________,滤渣Ⅱ的主要成分是_________。
(3)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线。则T1_________T2(填“>”或“<”)。

将钨酸钠溶液加入石灰乳得到大量钨酸钙,发生反应的离子方程式为_________________,T2时该反应的平衡常数为_________________。
(4)硬质合金刀具中含碳化钨(WC),利用电解法可以从碳化钨废料中回收钨。电解时,用碳化钨做阳极,不锈钢做阴极,HCl溶液为电解液,阳极析出钨酸并放出CO2。该阳极反应式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示细胞内某些有机物的元素组成和功能关系,其中A、B代表元素,Ⅰ、Ⅱ、Ⅲ、Ⅳ是生物大分子,图中X、Y、Z、P分别为构成生物大分子的基本单位。请回答下列问题:
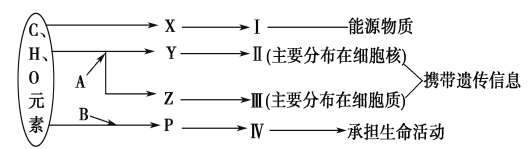
(1)图中X是________,I在小麦种子中主要是指______________。
(2)图中Z是________,使用甲基绿、派洛宁(吡罗红)混合染液染色,可使Ⅲ呈现________色。
(3)图中P的结构通式为________;写出由P形成Ⅳ的结构层次______________。
(4)Ⅲ和Ⅳ两者都有多样性,两者多样性的关系是前者________后者。
(5)构成细胞的化合物中,随着年龄增长明显减少的主要是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某制碱厂的生产流程示意图如下:

下列分析正确的是( )
A. 该制碱法是侯氏制碱法 B. 反应①中包含复分解反应
C. X中只含有Ca2+和Cl— D. 理论上,生产过程中无需补充CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W、L为五种短周期元素,非金属元素X最外层电子数与其周期序数相同,Y的最外层电子数是其所在周期数的2倍。Y在Z中充分燃烧能生成其最高价化合物YZ2。W+与Z2-具有相同的电子数。X在L中燃烧,产物XL溶于水得到一种强酸。请回答下列问题:
(1)X在周期表中的位置是_____。请写出实验室制备单质L的化学方程式______,尾气处理的离子方程式____________。
(2)由X分别与Y、Z形成的最简单化合物的稳定性关系为___________________。
(3)由X、Y、Z、W组成的一种盐,在面食中有大量使用,在其水溶液中滴入由X、Y、Z形成的厨房中常见的一种酸,反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上真空炼铷的原理为2RbCl+Mg ![]() MgCl2+2Rb(g),下列说法正确的是
MgCl2+2Rb(g),下列说法正确的是
A. 镁的金属活动性比铷强,故镁可置换铷
B. 铷的沸点比镁低,把铷蒸气抽出时,平衡右移
C. MgCl2的热稳定性比RbCl弱
D. Rb单质比RbCl更稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计如图所示的微型实验装置。实验时,现断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是
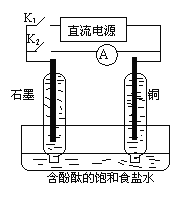
A. 断开K2,闭合K1时,总反应的离子方程式为:2H+ + 2Cl-![]() Cl2↑+H2↑
Cl2↑+H2↑
B. 断开K2,闭合K1时,石墨电极附近溶液变红
C. 断开K1,闭合K2时,铜电极上的电极反应为: Cl2+2e-=2Cl-
D. 断开K1,闭合K2时,石墨电极作正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据反应原理设计的应用,不正确的是
A. CO32- + H2O ![]() HCO3-+ OH- 热的纯碱溶液清洗油污
HCO3-+ OH- 热的纯碱溶液清洗油污
B. Al3+ + 3H2O ![]() Al(OH)3(胶体)+ 3H+ 明矾净水
Al(OH)3(胶体)+ 3H+ 明矾净水
C. SnCl2 + H2O ![]() Sn(OH)Cl↓ + HCl 配制氯化亚锡溶液时加入氢氧化钠
Sn(OH)Cl↓ + HCl 配制氯化亚锡溶液时加入氢氧化钠
D. TiCl4+ (x+2)H2O(过量) ![]() TiO2·x H2O↓ + 4HCl 用TiCl4制备TiO2
TiO2·x H2O↓ + 4HCl 用TiCl4制备TiO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com