
【题目】已知:A.金刚石、B.MgF2、C.NH4Cl、D.NaNO3、E.干冰、F.固体碘,填写下列空白。(用序号填写)
(1)熔化时不需破坏化学键的是________,熔化时只需破坏共价键的是________,熔点最低的是________,
晶体中既存在离子键又存在共价键的是________。
(2)意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1 mol N—N键吸收167 kJ热量,生成1 mol N≡N键放出942 kJ热量。根据以上信息和数据,则1 mol N4生成N2的ΔH=______ kJ·mol-1
(3) 50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的NaOH溶液在如图所示的装置中进行中和反应。
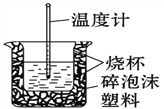
请回答下列问题:
从实验装置上看,图中尚缺少的一种玻璃仪器是_____,烧杯间填满碎泡沫塑料的作用是______。大烧杯上如不盖硬纸板,则求得的中和热数值_______(填“偏大”、“偏小”或“无影响”)。
【答案】 EF A E CD -882 环形玻璃搅拌棒 保温隔热,防止热量散失 偏小
【解析】一般来说,活泼金属元素与非金属元素形成离子键,非金属元素之间形成共价键,(1)分子晶体熔化不破坏化学键,即EF中熔化不破坏化学键,原子晶体熔化破坏共价键,则A熔化破坏共价键,一般来说,原子晶体熔点最高,分子晶体熔点较低,E的相对分子质量小于F,则E的熔点最低;离子晶体中一定存在离子键,C、D中非金属元素之间形成共价键;(2)由题意知,N≡N的键能为942kJ/mol,N-N键的键能为167kJ/mol,则1 mol N4生成N2的反应为: N4(g)=2N2(g),反应热等于反应物的总键能减去生成物的总键能,故反应热△H=6×167kJ/mo l -2×942kJ/mol =-882kJ/mol;(3)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器;烧杯间填满碎泡沫塑料的作用是保温隔热,防止热量散失;大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小。


科目:高中化学 来源: 题型:
【题目】某制碱厂的生产流程示意图如下:

下列分析正确的是( )
A. 该制碱法是侯氏制碱法 B. 反应①中包含复分解反应
C. X中只含有Ca2+和Cl— D. 理论上,生产过程中无需补充CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定条件下N2与H2反应生成NH3,请回答:
①若反应物的总能量为E1,生成物的总能量为E2,且E1>E2,则该反应为________(填“吸热”或“放热”)反应。
②已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为________________。
(2) N2H4和H2O2混合可作火箭推进剂,已知:16 g液态N2H4和足量氧气反应生成N2(g)和H2O(l),放出310.6 kJ的热量;2H2O2(l)===O2(g)+2H2O(l) ΔH=-196.4 kJ·mol-1。反应N2H4(g)+O2(g)===N2(g)+2H2O(l)的ΔH=____________kJ·mol-1。N2H4和H2O2反应生成N2(g)和H2O(l)的热化学方程式为_______________________________________。
(3)实验室用50 mL 0.50 mol·L-1盐酸与50 mL某浓度的NaOH溶液在如图所示装置中反应,通过测定反应过程中所放出的热量可计算中和热。该装置有两处明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名称为____________;实验室提供了0.50 mol·L-1和0.55 mol·L-1两种浓度的NaOH溶液,应选择_____________mol·L-1的NaOH溶液进行实验。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属的说法正确的是
A. 铝箔在空气中受热可以熔化且会发生剧烈燃烧
B. ![]() 在空气中燃烧,发出黄色火焰,生成白色固体
在空气中燃烧,发出黄色火焰,生成白色固体
C. 铁与水蒸气反应的产物是黑色的![]()
D. 铝制餐具不宜用来盛装酸性、碱性较强的食物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲图为一种新型污水处理装置,该装冒可利用一种微生物将有机废水的化学能直接转化为电能,乙图是种用惰性电极电解饱和食盐水的消毒液发生器。关于甲、乙的说法不正确的是

A. 装置甲的X极要与装置乙中的a极连接
B. 装置乙中b极的电极反应式为:2C1--2e-=Cl2↑
C. 当N极消耗lmol气体时,有2molH+通过离子交换膜
D. 若有机废水中主要含有淀粉,则装置甲中M极反应为:(C6H10O5)n+7nH2O-24ne-=6nCO2↑+24nH+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据反应原理设计的应用,不正确的是
A. CO32- + H2O ![]() HCO3-+ OH- 热的纯碱溶液清洗油污
HCO3-+ OH- 热的纯碱溶液清洗油污
B. Al3+ + 3H2O ![]() Al(OH)3(胶体)+ 3H+ 明矾净水
Al(OH)3(胶体)+ 3H+ 明矾净水
C. SnCl2 + H2O ![]() Sn(OH)Cl↓ + HCl 配制氯化亚锡溶液时加入氢氧化钠
Sn(OH)Cl↓ + HCl 配制氯化亚锡溶液时加入氢氧化钠
D. TiCl4+ (x+2)H2O(过量) ![]() TiO2·x H2O↓ + 4HCl 用TiCl4制备TiO2
TiO2·x H2O↓ + 4HCl 用TiCl4制备TiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中说明氨气具有还原性和碱性的是( )
A. 2NH3+3CuO=3Cu+N2+3H2O
B. 8NH3+3Cl3=6NH4Cl+N2
C. 4NH3+6NO![]() 5N2+6H2O
5N2+6H2O
D. NH3+HCl=NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为有效提升空气质量,国家强制各燃煤企业要对燃煤烟气进行脱硫、脱硝处理后排放。回答下列问题:
(1)燃煤烟气“脱硝”中涉及到的部分反应如下:
a.4NH3(g)+6NO(g) ![]() 5N2(g)+6H2O(g) △H 1
5N2(g)+6H2O(g) △H 1
b.4NH3(g)+5O2(g) ![]() 4NO(g)+6 H2O(g)△H2 =-925kJ·mol-1
4NO(g)+6 H2O(g)△H2 =-925kJ·mol-1
c.N2(g)+O2(g) ![]() 2NO(g)△H 3=+175kJ·mol-1
2NO(g)△H 3=+175kJ·mol-1
则△H 1=_____kJ/mol。
(2)向某恒容密闭容器中加入2molNH3、3molNO,在适当条件下发生(1)中反应a,反应过程中NO的平衡转化率随温度T、压强p的变化曲线如图所示:
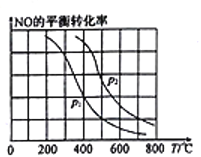
①p1________p2(填“>”“<”或“=”)。
②若在压强为加p2、温度为600℃时,达到平衡时反应体系内化学能降低了300kJ,则NO的转化率为_______________________。
③600℃时,下列各项数据中能表明该反应已达到化学平衡状态的是______。
a.水与NO的生成速率相等 b.混合气体的密度保持不变
c. NH3、NO生成速率比为5:4 d.容器的总压强保持不变
(3)将2molN2、3molH2O、0.5molNO的混合气体置于x、y、z三个容积相同的恒容密闭容器中,控制适当的条件发生反应,反应过程中c(NO)随时间的变化如图所示。
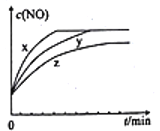
①在建立平衡的过程中,三个容器中反应速率的相对大小为______________。
②与y容器中反应相比,z容器中反应改变的条件及判断依据分别是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢。则A的结构简式是_____________。
(2)吗啡和海洛因都是严格查禁的毒品。吗啡分子中C、H、N、O的质量分数分别为71.58%、6.67%、4.91%和16.84%,已知其相对分子质量在200~300之间。吗啡的相对分子质量为_____________;吗啡的化学式为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com