
【题目】下列反应中说明氨气具有还原性和碱性的是( )
A. 2NH3+3CuO=3Cu+N2+3H2O
B. 8NH3+3Cl3=6NH4Cl+N2
C. 4NH3+6NO![]() 5N2+6H2O
5N2+6H2O
D. NH3+HCl=NH4Cl
【答案】B
【解析】
氨有还原性,则反应中化合价应升高,得到相应的氧化产物,氨有碱性,则应与酸生成相应的盐,据此解答。
A.在反应2NH3+3CuO![]() 3Cu+N2+3H2O中氮元素化合价升高,表现氨气的还原性,无铵盐生成,不能体现氨气的碱性,故A错误;
3Cu+N2+3H2O中氮元素化合价升高,表现氨气的还原性,无铵盐生成,不能体现氨气的碱性,故A错误;
B.在反应8NH3+3Cl3=6NH4Cl+N2中氮元素化合价升高,表现氨气的还原性,有铵盐生成,说明氨有碱性,故B正确;
C.在反应4NH3+6NO![]() 5N2+6H2O中,氮元素化合价升高,表现氨气的还原性,无铵盐生成,不能体现氨气的碱性,故C错误;
5N2+6H2O中,氮元素化合价升高,表现氨气的还原性,无铵盐生成,不能体现氨气的碱性,故C错误;
D.在反应NH3+HCl=NH4Cl中氮元素化合价不变,生成铵盐,只体现氨气的碱性,故D错误;
故答案选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述正确的是
A. 试剂X可以是氢氧化钠溶液,也可以是盐酸
B. 反应①、过滤后所得沉淀为氢氧化铁
C. 图中所示转化反应都不是氧化还原反应
D. 反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能一步实现的是( )
A. Fe ![]() Fe2O3
Fe2O3 ![]() FeCl3(aq)
FeCl3(aq)
B. N2 ![]() NH3
NH3 ![]() NO
NO
C. SiO2 ![]() H2SiO3
H2SiO3 ![]() Na2SiO3(aq)
Na2SiO3(aq)
D. Al2O3 ![]() Al(OH)3
Al(OH)3 ![]() AlCl3(aq)
AlCl3(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A.金刚石、B.MgF2、C.NH4Cl、D.NaNO3、E.干冰、F.固体碘,填写下列空白。(用序号填写)
(1)熔化时不需破坏化学键的是________,熔化时只需破坏共价键的是________,熔点最低的是________,
晶体中既存在离子键又存在共价键的是________。
(2)意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1 mol N—N键吸收167 kJ热量,生成1 mol N≡N键放出942 kJ热量。根据以上信息和数据,则1 mol N4生成N2的ΔH=______ kJ·mol-1
(3) 50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的NaOH溶液在如图所示的装置中进行中和反应。
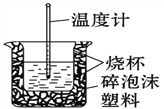
请回答下列问题:
从实验装置上看,图中尚缺少的一种玻璃仪器是_____,烧杯间填满碎泡沫塑料的作用是______。大烧杯上如不盖硬纸板,则求得的中和热数值_______(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4 +8H2O设计如下原电池,盐桥中装有饱和KCl溶液。下列说法正确的是

A. b电极上发生还原反应
B. 外电路电子的流向是从a到b
C. 电池工作时,盐桥中的SO42-移向甲烧杯
D. a电极上发生的反应为:MnO4-+8H++5e- = Mn2++4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用MnO2和浓盐酸制氯气的反应为MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑。反应中,如果有17.4 g纯MnO2被还原,那么:
MnCl2+2H2O+Cl2↑。反应中,如果有17.4 g纯MnO2被还原,那么:
(1)被氧化的氯化氢的质量为________________________________________________。
(2)转移电子的物质的量为________________________________________________。
(3)纺织工业中常用氯气作漂白剂,漂白布匹后,过量的氯需要除去,通常可用Na2SO3作“脱氯剂”,脱氯后的产物为Na2SO4,氯变为-1价。若把本题中产生的Cl2完全转化,需要Na2SO3的质量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对常温下0.1mol/L的醋酸溶液,以下说法正确的是
A. 由水电离出来的c(H+)=1.0×10-13mol/L
B. c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-)
C. 与同浓度的盐酸分别加水稀释10倍:pH(醋酸) <pH(盐酸)
D. 与等浓度等体积NaOH溶液反应后的溶液中:c(CH3COOH)+c(CH3COO-)=0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,将浓度均为0.1 mol·L-1,体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va + Vb=100 mL,Va、Vb与混合液pH的关系如图所示,下列说法正确的是
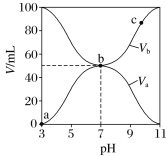
A. Ka(HA)=1×10-6
B. b点c(B+)=c(A-)=c(OH-)=c(H+)
C. a→c过程中水的电离程度始终增大
D. c点时,![]() 随温度升高而减小
随温度升高而减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组对某无色水样的成分进行检验,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Al3+、Ag+、Ca2+、CO32-、SO42-、Cl-中的若干种离子。该小组同学取100 mL水样进行实验,向水样中先滴加硝酸钡溶液,再滴加1 mol·L-1的硝酸,实验过程中沉淀质量的变化情况如图所示:
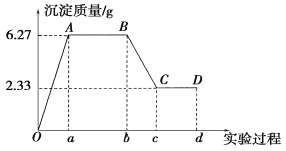
注明:Ob段表示滴加硝酸钡溶液;bd段表示滴加稀硝酸
(1)水样中一定含有的阴离子是________,其物质的量浓度之比为________。
(2)写出BC段所表示反应的离子方程式:__________________________________________。
(3)由B点到C点变化过程中消耗硝酸的体积为________。
(4)试根据实验结果推断K+是否存在?________(填“是”或“否”);若存在,K+的物质的量浓度c(K+)的范围是__________________。(若K+不存在,则不必回答该问)
(5)设计简单实验验证原水样中可能存在的离子:_____________________。(写出实验步骤、现象和结论)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com