
【题目】氨气能发生氧化反应:4NH3+5O2=4NO+6H2O,改变下列条件使反应速率加大,其中是由于增大了“活化分子”的百分数的是( )
A. 增加NH3浓度 B. 升高温度 C. 缩小体积增大压强 D. 降低温度
科目:高中化学 来源: 题型:
【题目】电解饱和食盐水,当阴极附近有0.8molNaOH生成时,导线中通过电子的物质的量是( )
A. 0.16mol B. 0.2mol C. 0.4mol D. 0.8 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型燃料电池能以乙烯为原料制备乙醛并获得电能,工作原理如图所示。下列说法正确的是
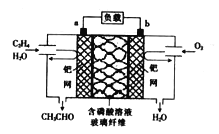
A. a电极为正极
B. 放电时,若有2mol电子转移,则理论上需要消耗28g乙烯
C. a极的电极反应式为CH2=CH2+2OH--2e-=CH3CHO+H2O
D. 电子移动方向:a电极→磷酸溶液→b电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在饱和硫酸铜溶液中,投入一块不规则的硫酸铜晶体,过一段时间后取出这块晶体,其形状______,经干燥其质量______,溶液浓度______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不能用勒夏特列原理解释的事实是
A. 碳酸钙不溶于水,但溶于盐酸
B. 由2NO2(g)![]() N2O4(g)组成的平衡体系,加压后颜色加深
N2O4(g)组成的平衡体系,加压后颜色加深
C. 高压比常压有利于合成氨的反应
D. 用热的纯碱溶液洗油污时,去污效果好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰及其化合物在现代工业及国防建设中具有十分重要的意义。回答下列问题:
(1)常用铝热法还原软锰矿(主要成分为MnO2)来制金属锰。因为铝与软锰矿反应剧烈,所以先在强热条件下将软锰矿转变为Mn3O4,然后再将其与铝粉混合。
①MnO2中Mn的化合价为____________________。
②铝粉与Mn3O4反应时,还原剂与氧化剂的物质的量之比为_________________。
(2)pH=0的溶液中,不同价态锰的微粒的能量(E)如图所示。若某种含锰微粒(如Mn3+)的能量处于相邻价态两种微粒(Mn2+和MnO2)能量连线的上方,则该该微粒不稳定,会发生歧化反应,转化为相邻价态的微粒。

①MnO42-______(填“能”或“不能”)稳定存在于pH=0的溶液中。
②实验室可利用以下反应检验Mn2+的存在:2Mn2++5S2O82-+8H2O==16H++10SO42-+2 MnO42-,确认Mn2+存在的现象是______________________;检验时必须控制Mn2+的浓度和用量,否则实验失败,理由是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaBH4是一种棕黄色固体,在酸性条件下易水解放出氢气,是最常用的还原剂之一,广泛用于有机合成和电镀等。一种制取NaBH4的工艺流程如下:

回答下列问题:
(1)步骤①用CH4与H2O(g)反应制H2的同时会生成CO2。0.4 mol CH4完全反应生成H2的物质的量为 __________________mol。
(2)步骤③发生反应的化学方程式为____________________________________。
(3)H3BO3是一元弱酸,其在水中的电离方程式为___________________________。
(4)从CH3ONa回收甲醇的方法是_______________________________。
(5)碱性条件下,NaBH4与CuSO4溶液反应可得到纳米铜和NaBO2,则该反应的离子方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面均是正丁烷与氧气反应的热化学方程式(25℃,101 kPa):
①C4H10(g)+![]() O2(g)===4CO2(g)+5H2O(l) ΔH=-2 878 kJ·mol-1
O2(g)===4CO2(g)+5H2O(l) ΔH=-2 878 kJ·mol-1
②C4H10(g)+![]() O2(g)===4CO2(g)+5H2O(g) ΔH=-2 658 kJ·mol-1
O2(g)===4CO2(g)+5H2O(g) ΔH=-2 658 kJ·mol-1
③C4H10(g)+![]() O2(g)===4CO(g)+5H2O(l) ΔH=-1 746 kJ·mol-1
O2(g)===4CO(g)+5H2O(l) ΔH=-1 746 kJ·mol-1
④C4H10(g)+![]() O2(g)===4CO(g)+5H2O(g) ΔH=-1 526 kJ·mol-1
O2(g)===4CO(g)+5H2O(g) ΔH=-1 526 kJ·mol-1
由此判断,正丁烷的燃烧热是
A. ΔH=-2 878 kJ·mol-1 B. ΔH=-2 658 kJ·mol-1
C. ΔH=-1 746 kJ·mol-1 D. ΔH=-1 526 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com