
【题目】用双线桥法标出电子转移的方向和数目
①Cl2+SO2 +2H2O=H2SO4 +2HCl ____________________
②2Na2O2+2H2O=4NaOH+O2↑____________________
【答案】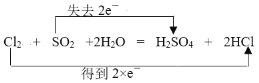

【解析】
①Cl2+SO2 +2H2O=H2SO4 +2HCl,Cl2中的Cl化合价降低,SO2中的S化合价升高。
②2Na2O2+2H2O=4NaOH+O2↑,Na2O2中的O既升高又降低。
①Cl2+SO2 +2H2O=H2SO4 +2HCl中Cl化合价降低,由0价降低到1价,得到1个电子,2个Cl降低得到2个电子,S化合价升高,由+4价变为+6价,因此用双线桥表示电子转移的方法为 ;故答案为:
;故答案为: 。
。
②2Na2O2+2H2O=4NaOH+O2↑,Na2O2中的O既升高又降低,由1价升高到0价,失去1个电子,得到一个氧气,转移2×e-,由1价降低到2价,得到1个电子,有2个1价O降低,因此转移2×e-,因此用双线桥表示电子转移的方法为 ;故答案为:
;故答案为: 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列关系正确的是
A. 沸点:新戊烷>2,2-二甲基戊烷>丙烷
B. 密度:CCl4>H2O>甲苯
C. 等质量的物质燃烧耗O2量:乙烷>乙烯>乙炔>甲烷
D. 等物质的量物质燃烧耗O2量:环己烷>苯>苯甲醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,设计正确且能达到实验目的的是
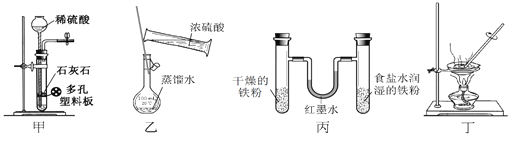
A. 甲用于实验室制取少量CO2 B. 乙用于配制一定物质的量浓度的硫酸
C. 丙用于模拟生铁的电化学腐蚀 D. 丁用于蒸干A1Cl3溶液制备无水AlC13
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知还原性:Cl-<Fe2+<I-<SO2,判断下列反应不能发生的是( )
A.2Fe3++SO2+2H2O=![]() +4H++2Fe2+
+4H++2Fe2+
B.I2+SO2+2H2O=H2SO4+2HI
C.I2+2Cl-=Cl2+2I-
D.2Fe3++2I-=2Fe2++I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)乙炔的电子式__________________。
(2)![]() 分子式:_________________。
分子式:_________________。
(3)![]() 其苯环上的一氯代物有______种
其苯环上的一氯代物有______种
(4)结构简式为![]() 此烃名称为___________________。
此烃名称为___________________。
(5) 4,4,5﹣三甲基﹣2﹣己炔(写出结构简式) ____________。
(6)结构简式为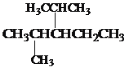 的烃可命名为:____________________。
的烃可命名为:____________________。
(7)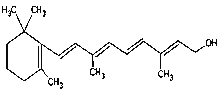 1mol该物质消耗_______molH2.
1mol该物质消耗_______molH2.
(8)鉴别苯,碘化钾溶液,硝酸银溶液,己烯,四氯化碳时,只能用一种试剂,该试剂是_________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g)![]() 2CO2(g)+S(s) ΔH<0,若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
2CO2(g)+S(s) ΔH<0,若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
A. 平衡前,随着反应的进行,容器内压强始终不变
B. 平衡时,若升高温度,CO体积分数增大,平衡常数变小
C. 平衡时,其他条件不变,分离出CO2,正反应速率加快
D. 平衡时,v正(SO2)=2v逆(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有一未知浓度的盐酸,某同学在实验室中进行实验测定盐酸的浓度。请完成下列填空:
配制100mL0.10molL-1NaOH标准溶液。需用托盘天平称量___g的氢氧化钠固体。
取20.00mL待测盐酸放入锥形瓶中,并滴加 2~3滴酚酞作指示剂,用配制的标准 NaOH溶液进行滴定。重复上述滴定操作 2~3次,记录数据如下:
滴定次数 | 待测盐酸的体积/mL | 0.10 mol/L NaOH 溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
第一次 | 20.00 | 2.00 | 28.15 |
第二次 | 20.00 | 1.50 | 29.50 |
第三次 | 20.00 | 0.20 | 26.55 |
①该实验滴定达到终点的标志是_________
②根据上述数据,可计算出该盐酸的浓度约为______。(保留两位有效数字)
③在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______。(双选)
A 滴定终点读数时俯视读数 B 酸式滴定管使用前,水洗后未用待测盐酸润洗
C 锥形瓶水洗后未干燥 D 碱式滴定管尖嘴部分有气泡,滴定后消失
E 称量NaOH 固体时,混入少量KOH杂质
④现用以上实验配制的0.10molL-1NaOH溶液滴定未知浓度的CHCOOH溶液,反应恰好完全时,下列叙述中正确的是_____
A 溶液呈中性,可选用甲基橙或酚酞作指示剂
B 溶液呈中性,只能选用石蕊作指示剂
C 溶液呈碱性,可选用甲基橙或酚酞作指示剂
D 溶液呈碱性,只能选用酚酞作指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高能LiFePO4电池,多应用于公共交通。电池中间是聚合物的隔膜, 主要作用是在反应过程中只让Li+通过。结构如图所示。
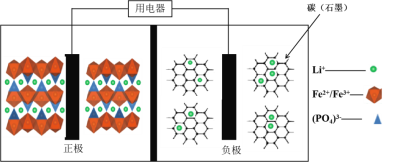
原理如下:(1-x)LiFePO4+xFePO4+LixCn![]() LiFePO4+nC。
LiFePO4+nC。
下列说法不正确的是( )
A. 放电时,正极电极反应式:xFePO4+xLi++xe-===xLiFePO4
B. 放电时,电子由负极经导线、用电器、导线到正极
C. 充电时,阴极电极反应式:xLi++xe-+nC===LixCn
D. 充电时,Li+向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向2 L恒容密闭容器中充入1 mol A,发生A(g)![]() B(g) + C(g)反应。反应过程中c(C) 随时间变化的曲线如下图所示,下列说法不正确的是
B(g) + C(g)反应。反应过程中c(C) 随时间变化的曲线如下图所示,下列说法不正确的是

A.反应在0 ~50 s的平均速率v(C) =1.6×10-3mol/(L·s)
B.该温度下,反应的平衡常数K = 0.025
C.保持其他条件不变,升高温度,平衡时c(B)=0.11mol/L,则该反应的ΔH<0
D.反应达平衡后,再向容器中充入1 mol A,该温度下再达到平衡时,0.1 mol/L<c(C)<0.2 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com