
【题目】已知还原性:Cl-<Fe2+<I-<SO2,判断下列反应不能发生的是( )
A.2Fe3++SO2+2H2O=![]() +4H++2Fe2+
+4H++2Fe2+
B.I2+SO2+2H2O=H2SO4+2HI
C.I2+2Cl-=Cl2+2I-
D.2Fe3++2I-=2Fe2++I2
【答案】C
【解析】
根据氧化还原反应中还原剂的还原性大于还原产物的还原性,可以判断氧化还原反应中物质的还原性强弱,同时也可以根据还原性的强弱反推氧化还原反应能否发生,通过逐一判断反应中的还原剂和还原产物,与题目中的还原性强弱顺序表,符合的可以发生,不符合的不可以发生来解题。
A.反应中还原剂为二氧化硫,还原产物为亚铁离子,还原性二氧化硫大于亚铁离子,故反应可以发生,A正确;
B.反应中还原剂为二氧化硫,还原产物为碘离子,还原性二氧化硫大于碘离子,故反应可以发生,B正确;
C.反应中还原剂为氯离子,还原产物为碘离子,而碘离子的还原性大于氯离子,故反应不能发生,C错误;
D.反应中还原剂为碘离子,还原产物为亚铁离子,还原性碘离子大于亚铁离子,故反应可以发生,D正确;
故选C。


 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D四种短周期元素,原子序数依次增大,B、C同周期,A、D同主族且A为非金属性最强的元素,C的原子结构示意图为![]() ,A、B可形成BA2型化合物。据此填空:
,A、B可形成BA2型化合物。据此填空:
(1)C的元素名称为____,其气态氢化物的化学式为_____。
(2)A、B、C、D四种元素的原子半径由大到小的顺序为___(用元素符号表示)。
(3)B和D的最高价氧化物对应的水化物反应的离子方程式是_____。
(4)某同学根据元素周期律推知:A元素和D元素最高价氧化物对应的水化物酸性前者强。该同学的推断是否正确?____,请说明理由:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用电子式表示H2O和MgBr2的形成过程:
H2O_________
MgBr2__________
(2)写出CO2、Na2O2、H2O2的电子式:
CO2___________Na2O2________ H2O2________
(3)A+、B+、C-、D、E 5种离子(分子或离子),它们分别含10个电子,已知它们有如下转化关系:
A.A++ C- → D + E b.B++ C- → 2D 。据此回答下列问题:
①写出A反应的离子方程式________;
②写出A+、C-离子的电子式:A+________ C-__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】传统接触法制取硫酸能耗大,污染严将燃料电池引人硫酸生产工艺可有效解决能耗和环境污染问题,同时提供电能。以燃料电池为电源电解硫酸铜溶液的工作原理示意图如下所示。

下列说法不正确的是( )
A. b极为正极,电极反应式为O2+4H++4e-=2H20
B. H+由a极通过质子交换膜向b极移动
C. 该燃料电池的总反应式为2SO2+O2+2H2O=2H2SO4
D. 若a极消耗2.24 L(标准状况)SO2,理论上c极,有6.4g铜析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲胺(CH3NH2)是合成太阳能敏化剂的原料。一定温度下,在三个体积均为2.0 L的恒容密闭容器中按不同方式投入反应物,发生反应CH3OH(g)+NH3(g) CH3NH2(g)+H2O(g),测得有关实验数据如下:
容器编号 | 温度/K | 起始物质的量(mol) | 平衡物质的量mol | ||||
CH3OH | NH3 | CH3NH2 | H2O | CH3NH2 | H2O | ||
I | 530 | 0.40 | 0.40 | 0 | 0 | 0.30 | |
II | 530 | 0.80 | 0.80 | 0 | 0 | ||
III | 500 | 0 | 0 | 0.20 | 0.20 | 0.16 | |
下列说法正确的是( )
A. 正反应的平衡常数K(Ⅰ)=K(Ⅱ)<K(Ⅲ)
B. 达到平衡时,体系中c(CH3OH)关系:2c(CH3OH,Ⅰ)>c(CH3OH,Ⅱ)
D. 530K时,若起始向容器Ⅰ中充入CH3OH 0.10 mol、NH3 0.15 mol、CH3NH2 0.10 mol、H2O 0.10 mol,则反应将向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图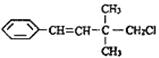 ,关于该有机物的下列叙述中不正确的是( )
,关于该有机物的下列叙述中不正确的是( )
A. 一定条件下,能发生加聚反应
B. 1mol该有机物在一定条件下最多能与4molH2发生反应
C. 能使酸性KMnO4溶液、溴水褪色,且原理相同
D. 该有机物苯环上的一溴代物有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用双线桥法标出电子转移的方向和数目
①Cl2+SO2 +2H2O=H2SO4 +2HCl ____________________
②2Na2O2+2H2O=4NaOH+O2↑____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,将10mL0.05mol/LH2SO4溶液加水稀释至100mL,稀释后溶液的pH=_____
(2)某温度时,测得0.01mol·L-1的NaOH溶液pH=10,则该温度下水的离子积常数KW=____,在该温度下,将pH=10的NaOH溶液aL与pH=1的稀硫酸bL混合,(设混合后溶液体积的微小变化忽略不计),若所得混合液pH=2,则a:b=____。
(3)将6gCH3COOH溶于水制成1L溶液,经测定溶液中含CH3COO–为1.4×10–3mol/L,此温度下醋酸的电离常数:Ka=_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物分子的叙述不正确的是( )
A. 乙烯分子中有一个sp2-sp2σ键和一个p-p π键
B. 乙炔每个碳原子都有两个未杂化的2p轨道,它们之间可形成两个π键
C. 乙烷两个C原子均是sp3杂化,分子中一共有6个σ键
D. 苯分子每个碳原子均是sp2杂化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com