
【题目】下面的电子结构中,第一电离能最小的原子可能是( )
A.ns2np3
B.ns2np5
C.ns2np4
D.ns2np6
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
【题目】在298K和101KPa时,2N2O5(g)=4NO2(g)+O2(g);△H=+56.7kJ/mol,能自发进行的合理解释是( )
A.是熵减反应
B.是熵增效应大于能量效应
C.是吸热反应
D.是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,判断下列叙述中正确的是( ) 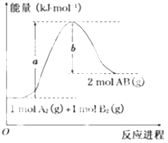
A.每生成2分子AB吸收b kJ热量
B.断裂1mol A﹣A和1mol B﹣B键,放出a kJ能量
C.该反应中反应物的总能量高于生成物的总能量
D.该反应热△H=+(a﹣b)kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将物质X逐渐加入(或滴入)Y溶液中,其生成沉淀的量与加入X的物质的量关系如下图所示,符合图示情况的是( )
A | B | C | D | |
X | CO2 | HCl | NaOH | AlCl3 |
Y | Ca(OH)2 | NaAlO2 | AlCl3 | NaOH |
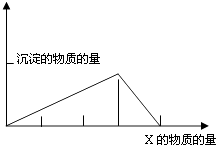
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组为研究电化学原理,设计如图装置.下列叙述不正确的是( ) 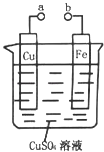
A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e﹣=Cu
C.a和b分别连接足够电压的直流电源正、负极时,Cu2+向铜电极移动
D.无论a和b是否用导线连接,铁片均溶解,溶液从蓝色逐渐变成浅绿色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将19.2g Cu溶于100mL浓度均为1molL﹣1的HNO3和H2SO4的混合溶液中,若产生的气体为NO,则产生的NO在标准状况下的体积为( )
A.2.24 L
B.1.68 L
C.3.36 L
D.1.12 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近期,我国个别企业违法排污导致地下水严重污染又成为媒体焦点.对水的质量监控有很多指标,其中水中溶解氧(DO)的多少是衡量水体自净能力的一个指标.Ⅰ .对溶解氧(DO)的测定步骤是: ①在一定温度下量取100.00mL新鲜水样,在碱性条件下使其中的O2将Mn2+氧化为MnO(OH)2:
2Mn2++O2+4OH﹣═2MnO(OH)2
②向步骤①反应后的溶液中加入KI溶液,使其中生成的MnO(OH)2再还原成Mn2+:
MnO(OH)2+2I﹣+4H+═Mn2﹣+I2+3H2O
③最后用0.0100molL﹣1 Na2S2O3标准溶液滴定步骤②中生成的I2:I2+2S2O32﹣═S4O62﹣+2I﹣ , 消耗Na2S2O3标准溶液11.00mL.
(1)步骤③使用的指示剂是淀粉试液.滴定终点时指示剂的颜色变化情况是 .
(2)硫代硫酸(H2S2O3)是一种二元弱酸.步骤③应选用滴定管进行滴定,结合离子方程式说明原因: .
(3)水样中溶解氧(DO)的浓度为mgL﹣1 .
(4)Ⅱ .该实验需用Na2S2O3固体配制100mL 0.0100molL﹣1 Na2S2O3标准溶液.请按配制的过程填写选用仪器的顺序:(填编号). ①玻璃棒 ②胶头滴管 ③100mL容量瓶 ④天平 ⑤25mL烧杯
(5)配制0.0100molL﹣1 Na2S2O3标准溶液时,下列操作使所配溶液浓度偏高的是 .
A.没有用蒸馏水洗涤烧杯
B.定容时俯视容量瓶刻度线
C.配制前容量瓶洗净后没干燥
D.摇匀后见液面下降,再加水至刻度线
E.用天平称量药品时,左盘低,右盘高.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaAlH4(氢化铝钠)和化合物甲都是重要的还原剂.一定条件下,由金属钠和H2反应生成甲,甲与水反应可产生H2 , 甲与AlCl3反应可得到NaAlH4 . 将4.80g甲加热至完全分解,得到金属钠和2.24L(已折算成标准状况)的H2 . 请推测并回答:
(1)NaAlH4中氢元素的化合价、甲的化学式为 .
(2)甲与AlCl3反应得到NaAlH4的化学方程式 .
(3)NaAlH4与盐酸反应的化学方程式为 .
(4)甲在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3),脱锈过程发生反应的化学方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com