
����Ŀ�����ڣ��ҹ�������ҵΥ�����۵��µ���ˮ������Ⱦ�ֳ�Ϊý�役�㣮��ˮ����������кܶ�ָ�꣬����ˮ���ܽ�����DO���Ķ����Ǻ���ˮ���Ծ�������һ��ָ�꣮�� �����ܽ�����DO���IJⶨ�����ǣ� ����һ���¶�����ȡ100.00mL����ˮ�����ڼ���������ʹ���е�O2��Mn2+����ΪMnO��OH��2��
2Mn2++O2+4OH���T2MnO��OH��2
������ٷ�Ӧ�����Һ�м���KI��Һ��ʹ�������ɵ�MnO��OH��2�ٻ�ԭ��Mn2+��
MnO��OH��2+2I��+4H+�TMn2��+I2+3H2O
�������0.0100molL��1 Na2S2O3����Һ�ζ�����������ɵ�I2��I2+2S2O32���TS4O62��+2I�� �� ����Na2S2O3����Һ11.00mL��
��1�������ʹ�õ�ָʾ���ǵ�����Һ���ζ��յ�ʱָʾ������ɫ�仯����� ��
��2��������ᣨH2S2O3����һ�ֶ�Ԫ���ᣮ�����Ӧѡ���ζ��ܽ��еζ���������ӷ���ʽ˵��ԭ�� ��
��3��ˮ�����ܽ�����DO����Ũ��ΪmgL��1 ��
��4���� ����ʵ������Na2S2O3��������100mL 0.0100molL��1 Na2S2O3����Һ���밴���ƵĹ�����дѡ��������˳�������ţ��� �ٲ����� �ڽ�ͷ�ι� ��100mL����ƿ ����ƽ ��25mL�ձ�
��5������0.0100molL��1 Na2S2O3����Һʱ�����в���ʹ������ҺŨ��ƫ�ߵ��� ��
A.û��������ˮϴ���ձ�
B.����ʱ��������ƿ�̶���
C.����ǰ����ƿϴ����û����
D.ҡ�Ⱥ��Һ���½����ټ�ˮ���̶���
E.����ƽ����ҩƷʱ�����̵ͣ����̸ߣ�
���𰸡�
��1����ɫ��Ϊ��ɫ���ڰ�����ڲ��ָ���ɫ
��2����ʽ�����������Ϊǿ�������Σ���������ˮ��ʹ��Һ�ʼ���S2O32��+H2O�THS2O3��+OH�� �� �ḯʴ��ʽ�ζ��ܻ�����SiO2+2OH��=SiO32��+H2O��
��3��8.8
��4���ܢݢ٢ۢ�
��5��BE
���������⣺��1���������۱����������ʵⱻ��ԭ�꣬����ɫ��ȥ������Ӳ��ָ���ɫ֤���ﵽ�ζ��յ㣻���Դ��ǣ���ɫ��Ϊ��ɫ���ڰ�����ڲ��ָ���ɫ����2��������ᣨH2S2O3����һ�ֶ�Ԫ���ᣮ��Ӧ��Ϊǿ�������Σ�ˮ���Լ��ԣ�Ӧ���ڼ�ʽ�ζ����У�ˮ�����ӷ���ʽS2O32��+H2O�THS2O3��+OH�� �� �ḯʴ��ʽ�ζ��ܻ�����SiO2+2OH��=SiO32��+H2O�����Դ��ǣ���ʽ�����������Ϊǿ�������Σ���������ˮ��ʹ��Һ�ʼ���S2O32��+H2O�THS2O3��+OH�� �� �ḯʴ��ʽ�ζ��ܻ�����SiO2+2OH��=SiO32��+H2O����3�����ݷ�Ӧ��2Mn2++O2+4OH���T2MnO��OH��2 �� MnO��OH��2+2I��+4H+�TMn2��+I2+3H2O��I2+2S2O32���TS4O62��+2I�� �� ��֪��ϵʽ��
O2��2MnO��OH��2��2I2�� | 4S2O32�� |
32g | 4mol |
m | 0.0100molL��1 ��11.00mL��10��3L/mL |
m= ![]() =8.8��10��4g��
=8.8��10��4g��
1Lˮ������������Ϊ��8.8��10��3g=8.8mg/L��
���Դ��ǣ�8.8����4�����Ʋ����г������ܽ⡢��Һ��ϴ�ӡ����ݡ�ҡ�ȵȲ�����
������ƽ�������ʵ����������ձ����ܽ⣬���ò��������裬��ȴ��ת�Ƶ�100mL����ƿ�У����ò���������������ˮ��Һ�����̶���1��2cmʱ�����ý�ͷ�ιܵμ�����Һ����̶���ˮƽ���У��Ǻ�ƿ��ҡ�ȣ���ѡ���������Ⱥ�˳���ǣ��ܢݢ٢ۢ����Դ��ǣ��ܢݢ٢ۢڣ���5��ͨ��������ϵc������Һ��= ![]() ����ʵ������ж�A��δ��ϴ���ձ��ڱڵ���Һת������ƿ��ʹ���Ƶ���Һ�����ʼ�С��c������Һ��Ũ��ƫ�ͣ���A�����ϣ�B������ʱ���ӿ̶��ߣ�����ˮ���ݣ��õ�����Һ���ڿ̶��ߣ�c������Һ����ҺŨ��ƫ��B���ϣ�C�����ձ�����Һת�Ƶ�����ƿ֮ǰ������ƿ������������ˮ��������c������Һ����ҺŨ����Ӱ�죬��C�����ϣ�D��ҡ�Ⱥ��Һ���½����ټ�ˮ���̶��ߣ����¼�ˮ�����̶��ߣ�Vƫ��c������Һ��Ũ��ƫ�ͣ���D�����ϣ�E������ƽ����ҩƷʱ�����̵ͣ����̸ߣ�˵���Ƶ�����ƫ�࣬n����c������Һ����ҺŨ��ƫ��E���ϣ����Դ��ǣ�BE��
����ʵ������ж�A��δ��ϴ���ձ��ڱڵ���Һת������ƿ��ʹ���Ƶ���Һ�����ʼ�С��c������Һ��Ũ��ƫ�ͣ���A�����ϣ�B������ʱ���ӿ̶��ߣ�����ˮ���ݣ��õ�����Һ���ڿ̶��ߣ�c������Һ����ҺŨ��ƫ��B���ϣ�C�����ձ�����Һת�Ƶ�����ƿ֮ǰ������ƿ������������ˮ��������c������Һ����ҺŨ����Ӱ�죬��C�����ϣ�D��ҡ�Ⱥ��Һ���½����ټ�ˮ���̶��ߣ����¼�ˮ�����̶��ߣ�Vƫ��c������Һ��Ũ��ƫ�ͣ���D�����ϣ�E������ƽ����ҩƷʱ�����̵ͣ����̸ߣ�˵���Ƶ�����ƫ�࣬n����c������Һ����ҺŨ��ƫ��E���ϣ����Դ��ǣ�BE��
�����㾫����������Ĺؼ�������������һ�����ʵ���Ũ�ȵ���Һ�����֪ʶ�������������ʵ���Ũ����Һʱ�������ձ�������ˮ������ƿ�̶���1cm��2cm���ٸ��ý�Ͷ�ιܼ�ˮ���̶��ߣ��Լ�������к͵ζ������⣬�˽��к͵ζ�ʵ��ʱ��������ˮϴ���ĵζ������ñ�Һ��ϴ����װ��Һ�����ô���Һ��ϴ������ȡҺ�壻�ζ��ܶ���ʱ�ȵ�һ�����Ӻ��ٶ������۲���ƿ����Һ��ɫ�ĸı�ʱ���ȵȰ������ɫ�����Ϊ�ζ��յ㣮


 �ܿ�����ĩ��̾�ϵ�д�
�ܿ�����ĩ��̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ˮ�е�NH4+ �� �������£� 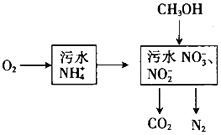
��1��������NH4+ת��ΪNO3����NO2�� �� ��ҺpH�����������С�����䡱����
��2�����ݽ��µ��о���������ֻ��NO2������ˮ�뺬NH4+����ˮ��������ϣ�ֱ��ת��Ϊ�����壬������Ϊ �� �˷������ŵ���
��3����ȫ������1mol NH4+��ˮ����n��O2����n��CH3OH����ϵʽΪ[��n��O2����n��CH3OH����ʾ]��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ĵ��ӽṹ�У���һ��������С��ԭ�ӿ����ǣ� ��
A.ns2np3
B.ns2np5
C.ns2np4
D.ns2np6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������װ�ÿ�Ӧ����ʵ���������������ն��Ȼ��̵�ʵ�飬�ܴﵽʵ��Ŀ���ǣ� �� 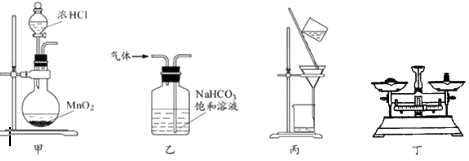
A.��װ�ü���ȡ����
B.��װ���ҳ�ȥ�����е������Ȼ���
C.��װ�ñ������MnCl2��Һ�еĹ���MnO2
D.��װ�ö��Ƶû��յĶ��Ȼ�������Ϊ5.36g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ��Ӧ�����ֻ�����Ӧ���͵Ĺ�ϵ��ͼ��ʾ�������з�Ӧ���ڱ�������ǣ� �� 
A.Cl2+2KBr�TBr2+2KCl
B.2NaHCO3 ![]() Na2CO3+H2O+CO2��
Na2CO3+H2O+CO2��
C.3Mg+N2 ![]() Mg3N2
Mg3N2
D.2Na2O2+2CO2�T2Na2CO3+O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӡˢ��·ʱ����FeCl3��Һ��ʴͭ����ʢ��FeCl3��Һ���ձ���ͬʱ�������ۺ�ͭ�ۣ���Ӧ���������н�������ܳ��ֵ���
A. �ձ�����ͭ���� B. �ձ���������ͭ
C. �ձ���ͭ�������� D. �ձ���ͭ������û��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����50mL18molL��1��ŨH2SO4�м���������CuƬ�����ȣ���ַ�Ӧ����ԭ��H2SO4�����ʵ���Ϊ�� ��
A.����0.9mol
B.����0.45mol
C.����0.45mol����0.9mol
D.��0.45mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���Ҳ���MgCl2��AlCl3�Ļ����Һ�������ˮ��Ӧ�Ʊ�MgAl2O4 �� ��Ҫ�������£� 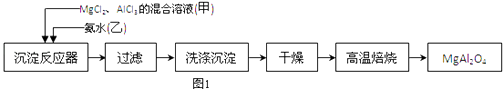
��1��ΪʹMg2+��Al3+ͬʱ���ɳ�����Ӧ���������Ӧ���м�������ס����ҡ������ٵμ���һ��Ӧ�
��2������ͼ��ʾ�����˲����е�һ�������� �� 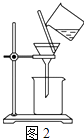
��3���ж������г����Ƿ�ϴ�����õ��Լ��� �� ���±���ʱ������ʢ�Ź�������������� ��
��4����ˮAlCl3��183������������ʪ��������������������ʵ���ҿ�������װ���Ʊ��� 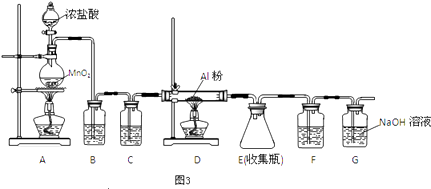
װ��B��ʢ�ű���NaCl��Һ����װ�õ���Ҫ������ �� F���Լ��������� �� ��һ������װ���ʵ��Լ���Ҳ����F��G�����ã���װ����Լ�Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������Һ�У����ܽ����Һ�����������
A. FeCl2��Һ B. ϡH2SO4
C. �ȵ�NaOH��Һ D. CuSO4��Һ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com