
【题目】处理生活污水中的NH4+ , 过程如下: 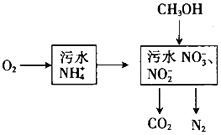
(1)空气将NH4+转变为NO3﹣或NO2﹣ , 溶液pH(填“增大”、“减小”或“不变”).
(2)根据较新的研究表明,将只含NO2﹣的污水与含NH4+的污水按比例混合,直接转化为无毒气体,该气体为 . 此方法的优点是
(3)完全处理含1mol NH4+污水,则n(O2)与n(CH3OH)关系式为[以n(O2)与n(CH3OH)表示].
【答案】
(1)减小
(2)N2;不消耗甲醇等还原剂,减少原材料
(3)4n(O2)=3+6n(CH3OH)
【解析】解:(1)空气将NH4+转变为NO3﹣(或NO2﹣)的反应为:NH4++2O2=NO3﹣+2H++H2O,酸性增强,pH减小;所以答案是:减小;(2)NO2﹣的污水与含NH4+的污水按比例混合,转化的无毒气体是氮气,此方法的优点是不消耗甲醇等还原剂,减少原材料,
所以答案是:N2;不消耗甲醇等还原剂,减少原材料; (3)处理含1mol NH4+污水,整个过程铵根离子、甲醇是还原剂,只有氧气是氧化剂,氧气得到的电子为4n(O2)mol,1molNH4+失电子为3mol,甲醇失电子为6n(CH3OH),根据得失电子守恒可知:4n(O2)=3+6n(CH3OH),
所以答案是:4 n(O2)=3+6n(CH3OH).


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图所示水槽中试管内有一枚铁钉,放置数天后观察:
(1)铁钉在逐渐生锈,则铁钉的腐蚀属于腐蚀。
(2)若试管内液面上升,则原溶液呈性,发生腐蚀,电极反应式为:负极: , 正极:。
(3)若试管内液面下降,则原溶液呈性,发生腐蚀。电极反应式为,负极: , 正极:。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在298K和101KPa时,2N2O5(g)=4NO2(g)+O2(g);△H=+56.7kJ/mol,能自发进行的合理解释是( )
A.是熵减反应
B.是熵增效应大于能量效应
C.是吸热反应
D.是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为某市所售盐酸试剂瓶标签上的部分数据.通过计算回答. 
(1)该盐酸中HCl的物质的量浓度.
(2)将6.50g锌投入足量的该盐酸中,充分反应后生成的H2在标准状况下的体积.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,现有①6.72 L CH4 ②3.01×1023个HCl分子 ③13.6 g H2S ④0.2 mol NH3,对这四种气体的关系有以下四种表述,其中不正确的是
A.体积:②>③>①>④ B.物质的量:②>③>④>①
C.质量:②>③>①>④ D.氢原子个数:①>③>④>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把7.4g Na2CO310H2O和NaHCO3组成的混合物溶于水配成100mL溶液,测得溶液中钠离浓度为0.6mol/L.若把等质量的混合物加热至恒重,残留物的质量是( )
A.3.18 g
B.2.12 g
C.4.22 g
D.5.28 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,判断下列叙述中正确的是( ) 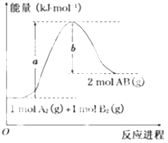
A.每生成2分子AB吸收b kJ热量
B.断裂1mol A﹣A和1mol B﹣B键,放出a kJ能量
C.该反应中反应物的总能量高于生成物的总能量
D.该反应热△H=+(a﹣b)kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近期,我国个别企业违法排污导致地下水严重污染又成为媒体焦点.对水的质量监控有很多指标,其中水中溶解氧(DO)的多少是衡量水体自净能力的一个指标.Ⅰ .对溶解氧(DO)的测定步骤是: ①在一定温度下量取100.00mL新鲜水样,在碱性条件下使其中的O2将Mn2+氧化为MnO(OH)2:
2Mn2++O2+4OH﹣═2MnO(OH)2
②向步骤①反应后的溶液中加入KI溶液,使其中生成的MnO(OH)2再还原成Mn2+:
MnO(OH)2+2I﹣+4H+═Mn2﹣+I2+3H2O
③最后用0.0100molL﹣1 Na2S2O3标准溶液滴定步骤②中生成的I2:I2+2S2O32﹣═S4O62﹣+2I﹣ , 消耗Na2S2O3标准溶液11.00mL.
(1)步骤③使用的指示剂是淀粉试液.滴定终点时指示剂的颜色变化情况是 .
(2)硫代硫酸(H2S2O3)是一种二元弱酸.步骤③应选用滴定管进行滴定,结合离子方程式说明原因: .
(3)水样中溶解氧(DO)的浓度为mgL﹣1 .
(4)Ⅱ .该实验需用Na2S2O3固体配制100mL 0.0100molL﹣1 Na2S2O3标准溶液.请按配制的过程填写选用仪器的顺序:(填编号). ①玻璃棒 ②胶头滴管 ③100mL容量瓶 ④天平 ⑤25mL烧杯
(5)配制0.0100molL﹣1 Na2S2O3标准溶液时,下列操作使所配溶液浓度偏高的是 .
A.没有用蒸馏水洗涤烧杯
B.定容时俯视容量瓶刻度线
C.配制前容量瓶洗净后没干燥
D.摇匀后见液面下降,再加水至刻度线
E.用天平称量药品时,左盘低,右盘高.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com