
【题目】把V L含有Na2SO4和MgSO4的混合溶液分成两等份,一份加入含a mol KOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钠离子的浓度为( )
A.2(2b-a)/V mol/LB.2(b-a)/V mol/LC.(2b-a)/V mol/LD.(b-a)/V mol/L
【答案】A
【解析】
一份加入含a mol KOH的溶液,恰好使镁离子完全沉淀为氢氧化镁,Mg2++2OH-=Mg(OH)2↓,则Mg2+~2OH-,则Mg2+的物质的量为![]() mol;根据硫酸镁的化学式MgSO4,则在V/2L溶液中,MgSO4中包含的SO42-为
mol;根据硫酸镁的化学式MgSO4,则在V/2L溶液中,MgSO4中包含的SO42-为![]() mol。
mol。
另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡;Ba2++SO42-=BaSO4↓,则在V/2L溶液中SO42-的物质的量为bmol;则V/2L溶液中,Na2SO4含有的SO42-的物质的量为(b-![]() )mol,根据硫酸钠的化学式Na2SO4,则V/2L溶液中,Na2SO4含有的Na+的物质的量为2 (b-
)mol,根据硫酸钠的化学式Na2SO4,则V/2L溶液中,Na2SO4含有的Na+的物质的量为2 (b-![]() )mol。
)mol。
将溶液一分为二,浓度不会发生改变,则原混合溶液中钠离子的浓度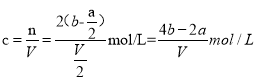 ,A项正确;
,A项正确;
答案选A。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏加德罗常数的值。下列说法正确的是
A.常温常压下,16 g O2 和 O3 的混合物所含的电子数为 8NA
B.标准状况下,2.24 L 水中所含的电子数为 NA
C.0.1 mol Na2O2 晶体中所含的离子数为 0.4NA
D.1 mol Fe 在氧气中充分燃烧失去的电子数为 3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组探究铝片做电极材料时的原电池反应,设计下表中装置进行实验并记录。
【实验1】
装置 | 实验现象 |
| 左侧装置电流计指针向右偏转,灯泡亮 右侧装置电流计指针向右偏转,镁条、铝条表面产生无色气泡 |
(1)实验1中,电解质溶液为盐酸,镁条做原电池的________极。
【实验2】
将实验1中的电解质溶液换为NaOH溶液进行实验2。
(2)该小组同学认为,此时原电池的总反应为2Al + 2NaOH + 2H2O ![]() 2NaAlO2 + 3H2↑,据此推测应该出现的实验现象为________。
2NaAlO2 + 3H2↑,据此推测应该出现的实验现象为________。
实验2实际获得的现象如下:
装置 | 实验现象 |
| i.电流计指针迅速向右偏转,镁条表面无气泡,铝条表面有气泡 ⅱ.电流计指针逐渐向零刻度恢复,经零刻度后继续向左偏转。镁条表面开始时无明显现象,一段时间后有少量气泡逸出,铝条表面持续有气泡逸出 |
(3)i中铝条表面放电的物质是溶解在溶液中的O2,则该电极反应式为________。
(4)ii中“电流计指针逐渐向零刻度恢复”的原因是________。
【实验3和实验4】
为了排除Mg条的干扰,同学们重新设计装置并进行实验3和实验4,获得的实验现象如下:
编号 | 装置 | 实验现象 |
实验3 |
| 电流计指针向左偏转。铝条表面有气泡逸出,铜片没有明显现象;约10分钟后,铜片表面有少量气泡产生,铝条表面气泡略有减少。 |
实验4 |
煮沸冷却后的溶液 | 电流计指针向左偏转。铝条表面有气泡逸出,铜片没有明显现象;约3分钟后,铜片表面有少量气泡产生,铝条表面气泡略有减少。 |
(5)根据实验3和实验4可获得的正确推论是________ (填字母序号)。
A. 上述两装置中,开始时铜片表面得电子的物质是O2
B. 铜片表面开始产生气泡的时间长短与溶液中溶解氧的多少有关
C. 铜片表面产生的气泡为H2
D. 由“铝条表面气泡略有减少”能推测H+在铜片表面得电子
(6)由实验1~实验4可推知,铝片做电极材料时的原电池反应与________等因素有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸亚铁晶体[CH3CH(OH)COO]2Fe·3H2O(M=288)是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸CH3CH(OH)COOH与FeCO3反应制得:
I.制备碳酸亚铁
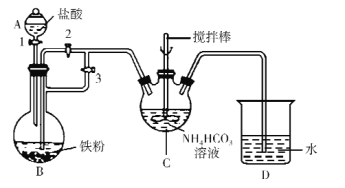
(1)仪器C的名称是_____。
(2)利用如图所示装置进行实验。首先关闭活塞2,打开活塞1、3,目的是____;关闭活塞1,反应一段时间后,关闭活塞____,打开活塞______,观察到B中溶液进入到C中,C中产生沉淀和气体,写出制备FeCO3的离子方程式____。
(3)装置D的作用是____。
Ⅱ.乳酸亚铁晶体的制备及纯度测定
将制得的FeCO3加入到乳酸溶液中,加入少量铁粉,在75℃下搅拌使之充分反应。然后再加入适量乳酸,从所得溶液中获得乳酸亚铁晶体。
(4)加入少量铁粉的作用是_____。
(5)若用KMnO4滴定法测定样品中Fe2+的量进而计算纯度时,发现结果总是大于100%,其主要原因是_________。
(6)经查阅文献后,改用Ce(SO4)2标准溶液进行滴定。反应中Ce4+离子的还原产物为Ce3+。测定时,先称取5.760g样品,溶解后进行必要处理,用容量瓶配制成250 mL溶液,每次取25.00mL,用0.1000mol·L-1Ce(SO4)2标准溶液滴定至终点,记录数据如下表所示。

则产品中乳酸亚铁晶体的纯度为___%(保留小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,CO2 加氢合成甲醇是合理利用 CO2 的有效途径。由 CO2 制备甲醇过程可能涉及反应如下:
反应Ⅰ:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH1=+41.19 kJ·mol-1
CO(g)+H2O(g) ΔH1=+41.19 kJ·mol-1
反应Ⅱ:CO(g)+2H2(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
反应Ⅲ:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH3=-49.58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH3=-49.58 kJ·mol-1
回答下列问题:
(1)反应Ⅲ的 ΔS_____(填“<”、“=”或“>”)0;反应Ⅱ的 ΔH2=_____。

(2)在恒压密闭容器中,充入一定量的 H2 和 CO2(假定仅发生反应Ⅲ),实验测得反应物在不同温度下,反应体系中 CO2 的平衡转化率与压强的关系曲线如图所示。
①比较T1与T2 的大小关系:T1_____T2 (填“ < ”、“= ”或“> ”) ,理由是:_____。
②在 T1 和 p6 的条件下,往密闭容器中充入 3 mol H2 和 1 mol CO2,该反应在第 5 min 时达到平衡,此时容器的体积为 1.8 L,则该反应在此温度下的平衡常数为_____。
a.若此条件下反应至 3 min 时刻,改变条件并于 A 点处达到平衡,CH3OH 的浓度随反应时间的变化趋势如图所示(3~4 min 的浓度变化未表示出来),则改变的条件为_____,请用 H2 的浓度变化计算从4 min 开始到A点的反应速率v(H2)=_____(保留两位小数)。
b.若温度不变,压强恒定在 p8 的条件下重新达到平衡时,容器的体积变为_____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫的催化氧化反应:2SO2(g)+O2(g)![]() 2SO3(g)是工业制硫酸的重要反应之一。
2SO3(g)是工业制硫酸的重要反应之一。
(1)①从平衡角度分析采用过量O2的原因是____________________。
②一定条件下,将0.10 mol SO2(g)和0.06 mol O2(g)放入容积为2 L的密闭容器中,反应在5min时达到平衡,测得c(SO3)=0.040 mol/L。
用SO2浓度变化来表示的化学反应速率为_________。
计算该条件下反应的平衡常数K=____________________________________。
③已知:该催化氧化反应K(300℃)>K(350℃)。则该反应正向是____________________反应(填“放热”或“吸热”)。平衡后升高温度,SO2的转化率_________(填“增大”、“减小”或“不变”)。

(2)某温度下,SO2的平衡转化率(![]() )与体系总压强(P)的关系如图1所示。平衡状态由A变到B时,平衡常数K(A)_________K(B)(填“>”、“<”或“=”,下同)。
)与体系总压强(P)的关系如图1所示。平衡状态由A变到B时,平衡常数K(A)_________K(B)(填“>”、“<”或“=”,下同)。
(3)保持温度不变,将等物质的量的SO2和O2混合气平分两份,分别加入起始体积相同的甲、乙两容器中,保持甲容器恒容,乙容器恒压到达平衡(如图2)。两容器的SO2的转化率关系为![]() 甲_________
甲_________![]() 乙。
乙。
(4)下图表示在密闭容器中二氧化硫的催化氧化反应达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a~b过程中改变的条件可能是_________;b~c过程中改变的条件可能是_________;若增大压强时,反应速率和化学平衡变化情况画在c~d处。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G是一种神经保护剂的中间体,某种合成路线如下:

根据上述转化关系,回答下列问题:
(1)芳香族化合物A的名称是___。
(2)D中所含官能团的名称是____。
(3)B—C的反应方程式为____。
(4)F—G的反应类型___。
(5)G的同分异构体能同时满足下列条件的共有____种(不含立体异构);
①芳香族化合物②能发生银镜反应,且只有一种官能团,其中,核磁共振氢谱显示为4组峰,且峰面积比为1:2:2:3的是__(写出一种结构简式)。
(6)参照上述合成路线,写出以![]() 和BrCH2COOC2H5为原料(无机试剂任选),制备
和BrCH2COOC2H5为原料(无机试剂任选),制备 的合成路线____________。
的合成路线____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是 ( )
A.常温常压下,22.4 L CCl4、CO2含有的分子数为1NA
B.常温常压下,1.06 g Na2CO3含有的Na+离子数为0.02NA
C.通常状况下,NA个CO2分子占有的体积约为22.4 L
D.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F是合成药物“银屑灵”的中间体,其合成流程如下:

回答下列问题:
(1)化合物A的名称为________,化合物C中含氧官能团结构简式为____________。
(2)写出A→B的化学方程式:________________________________。
(3)D→E的反应类型为__________,F的分子式为______________。
(4)写出同时满足下列条件的C的一种同分异构体的结构简式:____。
①能发生银镜反应
②能发生水解反应,其水解产物之一能与FeC13溶液发生显色反应
③分子中核磁共振氢谱为四组峰
(5)设计以甲苯、乙醛为起始原料(其它试剂任选),制备 的合成路线流程图:__________
的合成路线流程图:__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com