
【题目】科学家艾哈迈德·泽维尔使“运用激光技术观测化学反应时原子的运动”成为可能。泽维尔研究发现,当激光脉冲照射NaI时,Na+和I—两核间距在10~15![]() (埃,1
(埃,1![]() =1×10-10m),呈现离子键;当两核靠近约2.8
=1×10-10m),呈现离子键;当两核靠近约2.8![]() 时,呈现共价键。根据泽维尔的研究成果能得出的结论是( )
时,呈现共价键。根据泽维尔的研究成果能得出的结论是( )
A. NaI晶体是离子晶体和分子晶体的混合物
B. 共价键和离子键没有明显的界限
C. NaI晶体中既有离子键,又有共价键
D. 离子晶体可能含有共价键
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃仪器是________。
(2)烧杯间填满碎纸条的作用是________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值____________(填“偏大”、“偏小”或“无影响”)。
(4)该实验常用0.50 mol·L-1 HCl和0.55 mol·L-1 NaOH溶液各50 mL进行实验,其中NaOH溶液浓度大于盐酸浓度的作用是______,当室温低于10 ℃时进行实验,对实验结果会造成较大的误差,其原因是_____________。
(5)实验中改用60 mL 0.50 mol·L-1盐酸与50 mL 0.50 mol·L-1 NaOH溶液进行反应,与上述实验相比,所求得的中和热________(填“相等”或“不相等”),简述理由: ______________。
(6)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热ΔH将________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(![]() )在室温下稳定,加热至350℃左右迅速分解。实验室制备反应:
)在室温下稳定,加热至350℃左右迅速分解。实验室制备反应:![]() ,装置如图所示。下列说法错误的是( )
,装置如图所示。下列说法错误的是( )
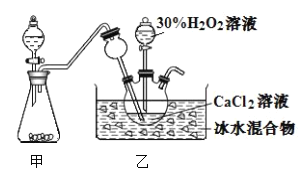
A.长颈漏斗可以起到防倒吸的作用
B.甲装置可以用浓氨水和碱石灰来制备氨气
C.冰水混合物的主要作用是防止生成的过氧化钙受热分解
D.反应过程中![]() 不断中和
不断中和![]() 和过氧化氢生成的
和过氧化氢生成的![]() ,促进反应进行
,促进反应进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制银氨溶液操作如图所示,下列说法错误的是( )
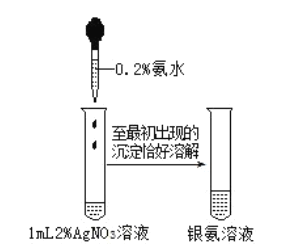
已知:![]() ,
,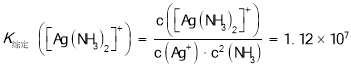
A.制得的银氨溶液可用于还原性糖的检验
B.![]() 中含有
中含有![]() 个
个![]() 键
键
C.银氨溶液不能长期存放,需要现用现配
D.![]() 固体可溶于氨水得到银氨溶液
固体可溶于氨水得到银氨溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器的名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
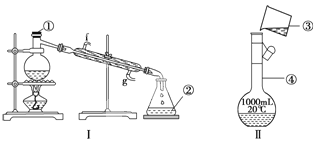
(1)写出下列仪器的名称:①__________,②__________,
(2)若利用装置Ⅰ分离四氯化碳和酒精的混合物,还缺少的仪器有______________,将仪器补充完整后进行的实验操作的名称为____________;
(3)用Na2CO3·10H2O晶体,配制0.2 mol·L-1的Na2CO3溶液480 mL。
①应称取Na2CO3·10H2O晶体的质量:__________。
②所用仪器除托盘天平、烧杯、玻璃棒、药匙、量筒外,还需要__________(填仪器名称)。
③根据下列操作对所配溶液的浓度产生的影响,完成下列要求:
A.Na2CO3·10H2O晶体失去了部分结晶水 |
B.用“左码右物”的称量方法称量晶体(使用游码) |
C.称量碳酸钠晶体时所用砝码生锈 |
D.容量瓶未经干燥使用 |
其中引起所配溶液浓度偏高的有___________(填字母)
④装置Ⅱ是某同学转移溶液的示意图,图中的错误是__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 把100 mL 3 mol·L-1的H2SO4跟100 mL H2O混合,硫酸的物质的量浓度为1.5 mol·L-1
B. 把100 g 20%的NaCl溶液跟100 g H2O混合后,NaCl溶液的质量分数是10%
C. 把200 mL 3 mol·L-1的BaCl2溶液跟100 mL 3 mol·L-1的KCl溶液混合后,溶液中的c(Cl-)仍然是3 mol·L-1
D. 把100 mL 20%的NaOH溶液跟100 mL H2O混合后,NaOH溶液的质量分数是10%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
(1)元素金(Au)处于周期表中的第6周期,与Cu同族,金原子最外层电子排布式为_________;一种铜合金晶体具有立方最密堆积的结构,在晶胞中铜原子处于面心,金原子处于顶点位置,则该合金中铜原子与金原子数量之比为_____,该晶体中,原子之间的作用力是________;
(2)上述晶体具有储氢功能,氢原子可进入到由铜原子与金原子构成的四面体空隙中。若将铜原子与金原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,该晶体储氢后的化学式应为_____________。
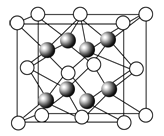
(3)CuSO4晶体的构成微粒是____和____,微粒间的作用力是_______,该晶体属于____晶体;
(4)SO42-中S以sp3杂化,SO42-的立体构型是__________________________;
(5)CuSO4粉末常用来检验一些有机物中的微量水分,其原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有效去除大气中的NOx,保护臭氧层,是环境保护的重要课题。
(1)在没有NOx催化时,O3的分解可分为以下两步反应进行;
①O3=O+O2 (慢) ②O+O3=2O2 (快)
第一步的速率方程为v1=k1c(O3),第二步的速率方程为v2=k2c(O3)·c(O)。其中O为活性氧原子,它在第一步慢反应中生成,然后又很快的在第二步反应中消耗,因此,我们可以认为活性氧原子变化的速率为零。请用k1、k2组成的代数式表示c(O)=____________。
(2)NO做催化剂可以加速臭氧反应,其反应过程如图所示:
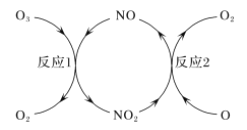
已知:O3(g)+O(g)=2O2(g) ΔH=-143 kJ/mol
反应1:O3(g)+NO(g)=NO2(g)+O2(g) ΔH1=-200.2 kJ/mol。
反应2:热化学方程式为____________________________。
(3)一定条件下,将一定浓度NOx(NO2和NO的混合气体)通入Ca(OH)2悬浊液中,改变![]() ,NOx的去除率如图所示。
,NOx的去除率如图所示。
已知:NO与Ca(OH)2不反应;

NOx的去除率=1-![]() ×100%
×100%
①![]() 在0.3-0.5之间,NO吸收时发生的主要反应的离子方程式为:___________。
在0.3-0.5之间,NO吸收时发生的主要反应的离子方程式为:___________。
②当![]() 大于1.4时,NO2去除率升高,但NO去除率却降低。其可能的原因是__________。
大于1.4时,NO2去除率升高,但NO去除率却降低。其可能的原因是__________。
(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-759.8 kJ/mol,反应达到平衡时,N2的体积分数随![]() 的变化曲线如图。
的变化曲线如图。
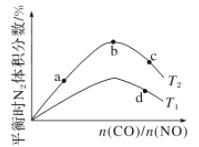
①b点时,平衡体系中C、N原子个数之比接近________。
②a、b、c三点CO的转化率从小到大的顺序为________;b、c、d三点的平衡常数从大到小的顺序为__________(以上两空均用a、b、c、d表示)。
③若![]() =0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为_____。
=0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是H2 和Cl2 反应生成HCl的能量变化示意图,由图可知( )
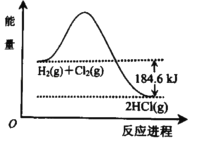
A. 反应物的能量总和小于生成物的能量
B. 生成1molHCl(g)需吸收92.3kJ的能量
C. H2(g)+Cl2(g)=2HCl(g)△H=﹣184.6 kJmol﹣1
D. H2(g)+Cl2(g)=2HCl(g)△H=﹣184.6 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com