
【题目】配制银氨溶液操作如图所示,下列说法错误的是( )
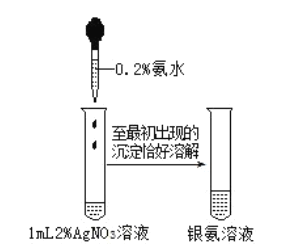
已知:![]() ,
,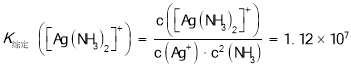
A.制得的银氨溶液可用于还原性糖的检验
B.![]() 中含有
中含有![]() 个
个![]() 键
键
C.银氨溶液不能长期存放,需要现用现配
D.![]() 固体可溶于氨水得到银氨溶液
固体可溶于氨水得到银氨溶液
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
【题目】[化学——选修2:化学与技术]
高锰酸钾(![]() )是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:
)是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:
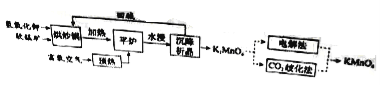
回答下列问题:
(1)原料软锰矿与氢氧化钾按1∶1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是 。
(2)“平炉”中发生的化学方程式为 。
(3)“平炉”中需要加压,其目的是 。
(4)将K2MnO4转化为KMnO4的生产有两种工艺。
①“![]() 歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成K2MnO4,MnO2和 (写化学式)。
歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成K2MnO4,MnO2和 (写化学式)。
②“电解法”为现代工艺,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为
,阴极逸出的气体是 。
③“电解法”和“![]() 歧化法”中,K2MnO4的理论利用率之比为 。
歧化法”中,K2MnO4的理论利用率之比为 。
(5)高锰酸钾纯度的测定:称取1.0800 g样品,溶解后定容于100 mL容量瓶中,摇匀。取浓度为0.2000 mol·L1的H2C2O4标准溶液20.00 mL,加入稀硫酸酸化,用KMnO4溶液平行滴定三次,平均消耗的体积为24.48 mL,该样品的纯度为
(列出计算式即可,已知2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物E(C11H12O2) 属于芳香酯类物质,天然物存在于威士忌酒、苹果酒等中,呈水果及玫瑰香气,可由下列路线人工合成:

完成下列填空:
(1)A中官能团的名称是________________;C物质的结构简式是________________。
(2)反应③的条件是_______________;反应④的类型是_____________________。
(3)写出反应⑥的化学方程式:__________________________________________________________________。
(4)如何检验反应②中的A是否完全转化?__________________________________________________________________。
(5)设计一条由![]() 出发,制备
出发,制备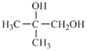 的合成路线(合成路线常用的表示方式为:
的合成路线(合成路线常用的表示方式为: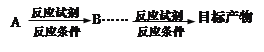 )______________________________。
)______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
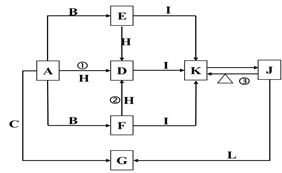
【题目】下列各物质中只有A、B、C三种单质,A的焰色反应为黄色,主要以G形式存在于海水中,F是一种淡黄色的固体,H是一种常见的无色液体,I是造成温室效应的“元凶”,各物质间的转化关系图如下:
回答下列问题:
(1)A是:____________, I是:____________(填化学式);
(2)按要求写出下列反应的方程式:
Ⅰ.①的化学方程式:______________________________;
Ⅱ.②的化学方程式(同时用双线桥法表示该反应的电子转移情况):________________;
Ⅲ. J与过量的澄清石灰水反应的离子方程式:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以苯甲醛为原料制备间溴苯甲醛的反应如下:
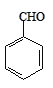 +Br2
+Br2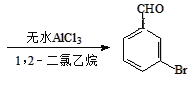 +HBr
+HBr
已知:(1)间溴苯甲醛温度过高时易被氧化。
(2)溴、苯甲醛、1,2-二氯乙烷、间溴苯甲醛的沸点见下表:
物质 | 溴 | 苯甲醛 | 1,2-二氯乙烷 | 间溴苯甲醛 |
沸点/℃ | 58.8 | 179 | 83.5 | 229 |
步骤1:将一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后装入三颈烧瓶(如图所示),缓慢滴加经浓硫酸干燥过的足量液溴,控温反应一段时间,冷却。
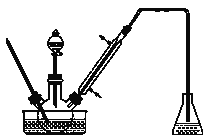
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机层用10% NaHCO3溶液洗涤。
步骤3:经洗涤的有机层加入适量无水MgSO4固体,放置一段时间后过滤出MgSO4nH2O晶体。
步骤4:减压蒸馏有机层,收集相应馏分。
(1)实验装置中冷凝管的主要作用是_______,锥形瓶中应为_______(填化学式)溶液。
(2)步骤1反应过程中,为提高原料利用率,适宜的温度范围为(填序号)_________。
A >229℃ B 58.8℃~179℃ C <58.8℃
(3)步骤2中用10% NaHCO3溶液洗涤,是为了除去溶于有机层的________(填化学式)。
(4)步骤3中加入无水MgSO4固体的作用是_______。
(5)步骤4中采用减压蒸馏,是为了防止_______。
(6)若实验中加入了5.3 g苯甲醛,得到3.7 g间溴苯甲醛。则间溴苯甲醛产率为___。
(7) ![]() 是一种重要的医药中间体。请设计合理方案用
是一种重要的医药中间体。请设计合理方案用![]() 合成这种中间体。(其他原料自选,用反应流程图表示,并注明必要的反应条件)。_______
合成这种中间体。(其他原料自选,用反应流程图表示,并注明必要的反应条件)。_______
例如:![]()
![]()
![]()
![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某无机化合物的二聚分子(小球大小只代表种类不同,与原子半径大小无关),该分子中A、B两种元素都是第3周期的元素,分子中所有原子的最外层电子数都达到8个电子的稳定结构。下列说法不正确的是 ( )

A. 该化合物的化学式是Al2Cl6
B. 该化合物是离子化合物,在熔融状态下能导电
C. 该化合物在固态时所形成的晶体是分子晶体
D. 该化合物中不存在离子键,也不含有非极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家艾哈迈德·泽维尔使“运用激光技术观测化学反应时原子的运动”成为可能。泽维尔研究发现,当激光脉冲照射NaI时,Na+和I—两核间距在10~15![]() (埃,1
(埃,1![]() =1×10-10m),呈现离子键;当两核靠近约2.8
=1×10-10m),呈现离子键;当两核靠近约2.8![]() 时,呈现共价键。根据泽维尔的研究成果能得出的结论是( )
时,呈现共价键。根据泽维尔的研究成果能得出的结论是( )
A. NaI晶体是离子晶体和分子晶体的混合物
B. 共价键和离子键没有明显的界限
C. NaI晶体中既有离子键,又有共价键
D. 离子晶体可能含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)5.4 g H2O的物质的量是_____,含有_________个水分子(用NA表示),含有____mol H。
(2)11.2L NH3(标况)约含_____ mol氢原子,_____ g的氮原子。
(3)6.02×1022个OH 的质量为____,含有质子的物质的量为_____,含有电子的物质的量为__ 。
(4)12.4 g Na2R含Na+0.4 mol,则Na2R的摩尔质量为_______,R的相对原子质量为_______。含R的质量为1.6 g的Na2R,其物质的量为________。
(5)物质的量相同的CO2和O2,其所含原子数目之比为_____,所含氧原子数目之比为______;质量相同的CO2和O2,其物质的量之比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组拟合成染料X和医药中间体Y。

已知:
![]()
CH3CH2Cl![]() CH3CH2CNCH3CH2COOH
CH3CH2CNCH3CH2COOH
(1)下列说法正确的是______
A.化合物A能与FeCl3溶液发生显色反应B.化合物E具有弱碱性
C.化合物X能发生加成、取代、还原反应
D.化合物Y的分子式为C20H23NO4
(2)化合物C的结构简式______
(3)写出D+E→X的化学反应方程式______
(4)写出同时符合下列条件的B的同分异构体的结构简式______
1H-NMR谱和IR谱检测表明:
①分子中有4种化学环境不同的氢原子;
②分子中含有苯环、甲氧基(-OCH3),-CH2Cl
(5)请设计以苯和乙烯为原料制备 的合成路线(用流程图表示,无机试剂任选)。合成路线流程图示例如下:CH3CH2OHCH3CHOCH3COOH______________
的合成路线(用流程图表示,无机试剂任选)。合成路线流程图示例如下:CH3CH2OHCH3CHOCH3COOH______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com