
【题目】铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
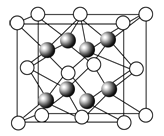
(1)元素金(Au)处于周期表中的第6周期,与Cu同族,金原子最外层电子排布式为_________;一种铜合金晶体具有立方最密堆积的结构,在晶胞中铜原子处于面心,金原子处于顶点位置,则该合金中铜原子与金原子数量之比为_____,该晶体中,原子之间的作用力是________;
(2)上述晶体具有储氢功能,氢原子可进入到由铜原子与金原子构成的四面体空隙中。若将铜原子与金原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,该晶体储氢后的化学式应为_____________。
(3)CuSO4晶体的构成微粒是____和____,微粒间的作用力是_______,该晶体属于____晶体;
(4)SO42-中S以sp3杂化,SO42-的立体构型是__________________________;
(5)CuSO4粉末常用来检验一些有机物中的微量水分,其原因是____________。
【答案】6s1 3∶1 金属键 Cu3AuH8 Cu2+ SO42- 离子键 离子 正四面体形 白色CuSO4粉末和水结合生成蓝色的CuSO4·5H2O晶体
【解析】
(1)元素金(Au)处于周期表中的第六周期,与Cu同族,则最外层电子数为1,以此判断电子排布式,利用均摊法计算晶胞;
(2)结合(1)的分析和CaF2的结构解答;
(3)CuSO4为离子化合物;
(4)SO42-中S以sp3杂化,没有孤电子对,据此判断SO42-的立体构型;
(5)无水硫酸铜是白色的,CuSO45H2O是蓝色的,显示水合铜离子特征蓝色,据此分析解答。
(1)元素金(Au)处于周期表中的第六周期,与Cu同族,则最外层电子数为1,则最外层电子排布式为6s1。在晶胞中Cu原子处于面心,N(Cu)=6×![]() =3,Au原子处于顶点位置,N(Au)=8×
=3,Au原子处于顶点位置,N(Au)=8×![]() =1,则该合金中Cu原子与Au原子数量之比为3:1,为金属晶体,原子间的作用力为金属键;故答案为:6s1;3∶1;金属键;
=1,则该合金中Cu原子与Au原子数量之比为3:1,为金属晶体,原子间的作用力为金属键;故答案为:6s1;3∶1;金属键;
(2)上述晶体具有储氢功能,氢原子可进入到由铜原子与金原子构成的四面体空隙中。若将铜原子与金原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相同,如图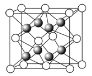 ,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,则应含有8个H,则化学式为Cu3AuH8,故答案为:Cu3AuH8;
,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,则应含有8个H,则化学式为Cu3AuH8,故答案为:Cu3AuH8;
(3)CuSO4为离子化合物,晶体的构成微粒是Cu2+和SO42-,微粒间的作用力是离子键,该晶体属于离子晶体,故答案为:Cu2+;SO42-;离子键;离子;
(4)SO42-中S以sp3杂化,没有孤电子对,SO42-的立体构型是正四面体形,故答案为:正四面体形;
(5)白色无水硫酸铜可与水结合生成蓝色的CuSO45H2O,显示水合铜离子特征蓝色,故答案为:白色无水硫酸铜可与水结合生成蓝色的CuSO45H2O晶体。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】A、B、C是原子序数依次增大的短周期主族元素,三种元素原子序数之和为35,且C的原子序数是A的2倍。A、B、C三种元素的单质在适当条件下可发生如图所示的变化。下列说法正确的是

A. 甲、乙、丙三种物质的水溶液均显碱性
B. 甲是碱性氧化物,乙是酸性氧化物
C. 甲、乙可能都有漂白性,其漂白原理相同
D. 丙的水溶液在空气中长期放置,溶液可能会变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以苯甲醛为原料制备间溴苯甲醛的反应如下:
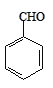 +Br2
+Br2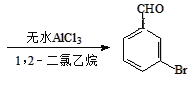 +HBr
+HBr
已知:(1)间溴苯甲醛温度过高时易被氧化。
(2)溴、苯甲醛、1,2-二氯乙烷、间溴苯甲醛的沸点见下表:
物质 | 溴 | 苯甲醛 | 1,2-二氯乙烷 | 间溴苯甲醛 |
沸点/℃ | 58.8 | 179 | 83.5 | 229 |
步骤1:将一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后装入三颈烧瓶(如图所示),缓慢滴加经浓硫酸干燥过的足量液溴,控温反应一段时间,冷却。
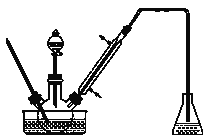
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机层用10% NaHCO3溶液洗涤。
步骤3:经洗涤的有机层加入适量无水MgSO4固体,放置一段时间后过滤出MgSO4nH2O晶体。
步骤4:减压蒸馏有机层,收集相应馏分。
(1)实验装置中冷凝管的主要作用是_______,锥形瓶中应为_______(填化学式)溶液。
(2)步骤1反应过程中,为提高原料利用率,适宜的温度范围为(填序号)_________。
A >229℃ B 58.8℃~179℃ C <58.8℃
(3)步骤2中用10% NaHCO3溶液洗涤,是为了除去溶于有机层的________(填化学式)。
(4)步骤3中加入无水MgSO4固体的作用是_______。
(5)步骤4中采用减压蒸馏,是为了防止_______。
(6)若实验中加入了5.3 g苯甲醛,得到3.7 g间溴苯甲醛。则间溴苯甲醛产率为___。
(7) ![]() 是一种重要的医药中间体。请设计合理方案用
是一种重要的医药中间体。请设计合理方案用![]() 合成这种中间体。(其他原料自选,用反应流程图表示,并注明必要的反应条件)。_______
合成这种中间体。(其他原料自选,用反应流程图表示,并注明必要的反应条件)。_______
例如:![]()
![]()
![]()
![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家艾哈迈德·泽维尔使“运用激光技术观测化学反应时原子的运动”成为可能。泽维尔研究发现,当激光脉冲照射NaI时,Na+和I—两核间距在10~15![]() (埃,1
(埃,1![]() =1×10-10m),呈现离子键;当两核靠近约2.8
=1×10-10m),呈现离子键;当两核靠近约2.8![]() 时,呈现共价键。根据泽维尔的研究成果能得出的结论是( )
时,呈现共价键。根据泽维尔的研究成果能得出的结论是( )
A. NaI晶体是离子晶体和分子晶体的混合物
B. 共价键和离子键没有明显的界限
C. NaI晶体中既有离子键,又有共价键
D. 离子晶体可能含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①标准状况下,6.02×1023个分子所占的体积约是22.4 L
②0.5 mol H2所占体积为11.2 L
③标准状况下,1 mol H2O的体积为22.4 L
④标准状况下,28 g CO与N2的混合气体的体积约为22.4 L
⑤各种气体的气体摩尔体积都约为22.4 L·mol-1
⑥标准状况下,体积相同的气体的分子数相同
A. ①③⑤B. ④⑥C. ②④⑥D. ①④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)5.4 g H2O的物质的量是_____,含有_________个水分子(用NA表示),含有____mol H。
(2)11.2L NH3(标况)约含_____ mol氢原子,_____ g的氮原子。
(3)6.02×1022个OH 的质量为____,含有质子的物质的量为_____,含有电子的物质的量为__ 。
(4)12.4 g Na2R含Na+0.4 mol,则Na2R的摩尔质量为_______,R的相对原子质量为_______。含R的质量为1.6 g的Na2R,其物质的量为________。
(5)物质的量相同的CO2和O2,其所含原子数目之比为_____,所含氧原子数目之比为______;质量相同的CO2和O2,其物质的量之比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,其中W元素的原子最外层电子数是内层电子数的2倍。下列说法正确的是
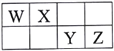
A. 原子半径大小:Z>Y>X
B. 最高价氧化物对应水化物的酸性:W>Y>Z
C. Y单质具有杀菌能力,Y与W可形成化合物WY2
D. W元素和氢元素形成的化合物可与Z单质反应,但不能与Z的氢化物反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应2A(s)+3B(g) ![]() C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v(正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高
A.①②B.④C.③D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
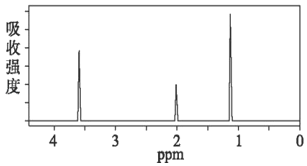
【题目】取0.92 g由C、H、O三种元素组成的有机物A,在足量氧气中完全燃烧,若将燃烧产物通过碱石灰,碱石灰质量增加2.84 g;若将燃烧产物通过浓硫酸,浓硫酸质量增加1.08 g;已知:A的蒸气对氢气的相对密度为23。
(1)A的分子式是_____;
(2)A的1H核磁共振谱图如图所示,写出其结构简式:_____;它的一种同分异构体的结构简式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com