
【题目】工业上用某矿渣(含有Cu2O(主要)、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下:

已知:Cu2O+2H+=Cu+Cu2++H2O
沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
(1)固体混合物A中的成分是______________.
(2)反应Ⅰ完成后,铁元素的存在形式为_____________.(填离子符号)请写出生成该离子的离子方程式_________________________.
(3)沉淀B可用于制造铁红,为了保证铁红的质量则x的取值为_____________。
(4)书写出由沉淀C制备铝的化学方程式:___________________。
【答案】 SiO2 , Cu Fe2+ 2Fe3++ Cu = 2Fe2++ Cu2+ 3.2≤X<4.0 2Al(OH)3=Al2O3+3H2O 2Al2O3![]() 4Al+3O2↑
4Al+3O2↑
【解析】(1)加入硫酸发生了反应:Cu2O+2H+=Cu+Cu2++H2O,故固体A的成分是SiO2和Cu;(2)由于发生了反应2Fe3++ Cu = 2Fe2++ Cu2+,溶液中铁元素的存在形式为:Fe2+;(3)目标沉淀氢氧化铁灼烧分分解生成铁红氧化铁,根据氢氧化铁开始沉淀和沉淀结束的PH关系,x范围是:3.2≤PH<4.0;(4)沉淀C是氢氧化铝,调节PH在5.2≤PH<5.4,沉淀氢氧化铝灼烧分解产生氧化铝,电解氧化铝制得铝单质,其反应的化学方程式为:2Al(OH)3![]() Al2O3+3H2O,2Al2O3
Al2O3+3H2O,2Al2O3![]() 4Al+3O2↑。
4Al+3O2↑。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】【化学—选修3物质结构与性质】
氮、磷、砷的单质及其化合物在生产生活中有重要的作用。回答下列问题:
(1)N元素原子核外电子排布图为____________,基态As原子有________种不同能量的电子。
(2)NO2-与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。NO2-离子中N原子的杂化方式为__________,K3[Co(NO2)6]是黄色沉淀,该物质中四种元素的电负性由大到小的顺序是 。
(3)N、P、As氢化物沸点由高到低的顺序是 ,原因是 。
(4)根据结构与性质的关系,说明H3AsO4的酸性比H3AsO3强的原因: 。
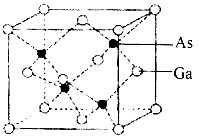
(5)砷化镓属于第三代半导体,晶胞结构如图。晶胞中距离Ga原子等距最近的Ga原子有 个,Ga与周围等距最近的As形成的空间构型为____________。已知砷化镓晶胞边长为a pm,NA表示阿伏加德罗常数的数值,其密度为 gcm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:

(1)定性分析:
①如图甲可通过观察_____________________________________,定性比较得出结论。
②有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是__________________,
③若H2O2在二氧化锰催化作用下发生反应,曾检测出有物质MnO3出现,写出整个反应过程的两个化学方程式:___________________________,________________________。
(2)定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为________,实验中需要测量的数据是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以苯酚为原料合成 ![]() 的路线如图所示.请按要求作答
的路线如图所示.请按要求作答

(1)写出鉴别苯酚与A这2种有机物的方法,用必要的文字说明: .
(2)写出以下物质的结构简式:B ,F .
(3)写出反应④的化学反应方程式:④ ,
(4)反应⑤可以得到E,同时可能得到的副产物的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl是一种化工原料,可以制备一系列物质(如图)。下列说法正确的是()

A. 25℃,NaHCO3在水中的溶解度比Na2CO3的大
B. 石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂
C. 常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应
D. 如图所示转化反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有M、A、B、D、N、E六种短周期元素,原子序数依次增大,M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期中最大的,A、B、D、E四种元素在周期表中的相应位置如下图,它们的原子序数之和为37。下列说法不正确的是
![]()
A.A、B、D、E四种元素分别与M元素形成的简单化合物中,稳定性最强的是H2O
B.M、D、E、N形成的简单离子的半径大小:S2>O2>Na+>H+
C.A、B、D、M可组成多种含18电子的分子,如CH3OH、CH3CH3、CH3NH2等
D.B元素的氢化物与D元素的单质在一定条件下能发生置换反应,且氧化剂与还原剂的物质的量之比为4∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学想通过下图装置实验,探究 SO2 与 Na2O2反应的产物。

Ⅰ、检验反应中是否有 O2 生成的方法是_______________________________________;若有 O2 生成,请写出装置 C 中的化学方程式:________________________。
Ⅱ、A 中盛装 H2SO4 溶液的仪器名称是________;D 装置除起了防止空气中的水蒸气和二氧化碳进入 C 装置与 Na2O2 反应作用外,还可以________________________________。
Ⅲ、(1)C 中固体产物可能有三种情况:①只有 Na2SO3;②只有________;③Na2SO3 和 Na2SO4 混合物。
(2)若 Na2O2 反应完全,为确定 C 中固体产物的成分,该同学设计如下,请您利用限选试剂和仪器帮助他完成该探究过程。限选试剂和仪器:
0.01 mol·L-1 KMnO4酸性溶液 0.1 mol·L-1 Ba(NO3)2 溶液 0.1 mol·L BaCl2
1 mol·L-1 HNO3 溶液 1 mol·L-1 盐酸、试管、胶头滴管。
实验操作 | 预期现象和结论 |
步骤一:取少量 C 中固体产物 于试管中,加入适量的蒸馏水、 搅拌溶解,分别取少量于 A、B 试管中 | 固体完全溶解,得到无色透明溶液 |
步骤二:取试管 A,向溶液中 加入________________,振荡,观察溶液颜色变化 | __________________________ |
步骤三:取试管 B,向其中先 加入__________________ ,振 荡;再加入_______________,振荡 | 产生气泡 ,再加入 另一试剂看到产生白色沉淀, 则固体 C 中还含有________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组反应中最终肯定是白色沉淀的是( )
A. 单质钠投入 MgCl2溶液 B. AlCl3溶液中加入过量KOH溶液
C. FeCl2溶液中加入过量氨水 D. Fe2(SO4)3溶液中加入过量KOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题:


定性分析:(1)如图甲所示可通过观察____________________,定性比较得出结论.
(2)有同学提出试剂的选择不妥,应将FeCl3改为更为_____________合理。
(3)H2O2在二氧化锰作用下发生的反应可分为两步,第一步的方程式为:2MnO2+H2O2=2HMnO3,第二步的化学方程式为:___________________________,若第一步反应慢第二步反应快,则总反应速率由_____________(填“第一步”或“ 第二步”)决定。
定量分析:(4)如图乙所示,以实验时均生成40mL气体为准,其他可能影响实验的因素均已忽略.实验中需要测量的数据是:_____________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com