
【题目】某同学想通过下图装置实验,探究 SO2 与 Na2O2反应的产物。

Ⅰ、检验反应中是否有 O2 生成的方法是_______________________________________;若有 O2 生成,请写出装置 C 中的化学方程式:________________________。
Ⅱ、A 中盛装 H2SO4 溶液的仪器名称是________;D 装置除起了防止空气中的水蒸气和二氧化碳进入 C 装置与 Na2O2 反应作用外,还可以________________________________。
Ⅲ、(1)C 中固体产物可能有三种情况:①只有 Na2SO3;②只有________;③Na2SO3 和 Na2SO4 混合物。
(2)若 Na2O2 反应完全,为确定 C 中固体产物的成分,该同学设计如下,请您利用限选试剂和仪器帮助他完成该探究过程。限选试剂和仪器:
0.01 mol·L-1 KMnO4酸性溶液 0.1 mol·L-1 Ba(NO3)2 溶液 0.1 mol·L BaCl2
1 mol·L-1 HNO3 溶液 1 mol·L-1 盐酸、试管、胶头滴管。
实验操作 | 预期现象和结论 |
步骤一:取少量 C 中固体产物 于试管中,加入适量的蒸馏水、 搅拌溶解,分别取少量于 A、B 试管中 | 固体完全溶解,得到无色透明溶液 |
步骤二:取试管 A,向溶液中 加入________________,振荡,观察溶液颜色变化 | __________________________ |
步骤三:取试管 B,向其中先 加入__________________ ,振 荡;再加入_______________,振荡 | 产生气泡 ,再加入 另一试剂看到产生白色沉淀, 则固体 C 中还含有________ |
【答案】 2SO2+2Na2O2===2 Na2SO3+O2 用带火星的木条靠近干燥管口a,观察木条是否复燃 分液漏斗 吸收过量(或多余)的SO2,以免污染空气 Na2SO4 几滴 0.01 mol·L-1 KMnO4酸性溶液 过量的1mol/L盐酸 1mol/LBaCl2 紫红色的KMnO4溶液振荡后褪色则C中有 __Na2SO3 Na2SO4
【解析】Ⅰ、由于氧气具有助燃性,能使带火星的木条复燃,所以用带火星的木条靠近管口a,若木条复燃,说明有氧气生成,否则没有;CO2和Na2O2反应的化学方程式为2CO2+2Na2O2=2Na2CO3+O2,SO2和Na2O2反应与CO2和Na2O2反应相似,若有O2生成,则反应的化学方程式为:2SO2+2Na2O2=2Na2SO3+O2;
Ⅱ、实验室制备二氧化硫用浓硫酸和亚硫酸钠反应,所用反应仪器为分液漏斗和锥形瓶,通过分液漏斗向烧瓶中加入适量的浓硫酸,二氧化硫是污染性气体,不能直接排放到空气中,而二氧化硫是酸性气体能与碱性物质反应,所以用碱石灰吸收二氧化硫防止污染空气;
Ⅲ、(1)过氧化钠有强氧化性,二氧化硫有还原性,S元素的化合价应由+4价升高到+6价,所以过氧化钠和二氧化硫能发生氧化还原反应生成硫酸钠,SO2+Na2O2=2Na2SO4;
(2)步骤一、二:取少量C中固体产物于试管中,加入适量的蒸馏水溶解,分别取少量于A、B试管中,固体完全溶解,得到无色透明溶液,取试管A,加入几滴(或少量)0.01 mol/LKMnO4酸性溶液,紫红色的KMnO4溶液振荡后褪色,证明C中含有Na2SO3,若无此现象则只含有Na2SO4;步骤三:取试管B,向其中先加入过量的1mol/L盐酸,再加入适量的0.1mol/L氯化钡溶液,生成无色刺激性气味的气体,出现白色沉淀,则Na2SO4和Na2SO3两种都有;答案如下:
几滴(或少量)0.01 mol/LKMnO4酸性溶液 | 紫红色的KMnO4溶液振荡后褪色,证明C中含有Na2SO3, |
过量的1mol/L盐酸,再加入适量的0.1mol/L氯化钡溶液 | 无色刺激性气味的气体;Na2SO4 |


科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式:
(1)实验室制取乙炔___________________。
(2)2 -氯丙烷的消去反应___________________。
(3)用甲苯制TNT的反应___________________。
(4)l,2-二氯乙烷与NaOH溶液共热___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有易溶强电解质的混合溶液10 L,其中可能含K+、Ba2+、Na+、![]() 、Cl、
、Cl、![]() 、
、![]() 、OH中的几种,向其中通入CO2气体,产生沉淀的量与通入CO2的量之间的关系如下图所示:
、OH中的几种,向其中通入CO2气体,产生沉淀的量与通入CO2的量之间的关系如下图所示:
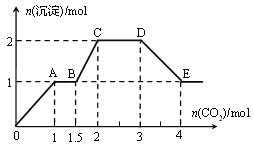
下列说法正确的是
A.该溶液中能确定存在的离子是Ba2+、![]() 、
、![]()
B.肯定不存在的离子是![]() 、OH
、OH
C.若不能确定的离子中至少还存在一种阳离子,则该离子的最小浓度为0.2 mol·L1
D.OA 段反应的离子方程式:2![]() +CO2+3H2O===2Al(OH)3↓+
+CO2+3H2O===2Al(OH)3↓+![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用某矿渣(含有Cu2O(主要)、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下:

已知:Cu2O+2H+=Cu+Cu2++H2O
沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
(1)固体混合物A中的成分是______________.
(2)反应Ⅰ完成后,铁元素的存在形式为_____________.(填离子符号)请写出生成该离子的离子方程式_________________________.
(3)沉淀B可用于制造铁红,为了保证铁红的质量则x的取值为_____________。
(4)书写出由沉淀C制备铝的化学方程式:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将100 mL 0.30 mol·L-1的Na2SO4溶液和50 mL 0.20 mol·L-1的Al2(SO4)3溶液混合后,所得溶液中SO42-的物质的量浓度为
A. 0.20 mol·L-1 B. 0.25 mol·L-1
C. 0.40 mol·L-1 D. 0.50 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
(1) H2(g)+1/2O2(g)=H2O(g) ΔH1=a kJ/mol;
(2) 2H2(g)+O2(g)=2H2O(g) ΔH2=b kJ/mol;
(3) H2(g)+1/2O2(g)=H2O(l) ΔH3=c kJ/mol;
(4) 2H2(g)+O2(g)=2H2O(l) ΔH4=d kJ/mol
下列关系式中正确的是
A.a<c<0
B.b>d>0
C.2a=b<0
D.2c=d>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由铁、锌、铝、镁四种金属中的两种组成的混合物11 g,与足量的盐酸反应产生的氢气在标准状况下为11.2 L,则混合物中一定含有的金属是( )
A. 铁 B. 锌 C. 镁 D. 铝
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com