
【题目】如图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
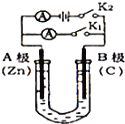
(1)打开K2,合并K1,若所盛溶液为CuSO4溶液:则A为 极,A极的电极反应式为 .若所盛溶液为KCl溶液:则B极的电极反应式为 .
(2)打开K1,合并K2,若所盛溶液为滴有酚酞的NaCl溶液,则A电极附近可观察到的现象是 ,Na+移向 极(填A、B);B电极上的电极反应式为 ,总反应化学方程式是 .
(3)如果要用电解的方法精炼粗铜,打开K1,合并K2,电解液选用CuSO4溶液,则A电极的材料应换成是 (填“粗铜”或“纯铜”),电极反应式是 ,反应一段时间后电解质溶液中Cu2+的浓度将会 (填“增大”、“减小”、“不变”).
【答案】(1)负;Zn﹣2e﹣=Zn2+;O2+2H2O+4e﹣=4OH﹣;
(2)有无色气体产生,电极附近溶液变红;A;2Cl﹣﹣2e﹣=Cl2↑;
2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;(3)纯铜;Cu2++2e﹣=Cu;减小。
2NaOH+H2↑+Cl2↑;(3)纯铜;Cu2++2e﹣=Cu;减小。
【解析】
试题分析:(1)打开K2,闭合K1,此装置是原电池的装置,根据构成原电池的条件,活泼金属作负极,即A极为负极,B极为正极,负极上失去电子,化合价升高,因此负极反应式为Zn-2e-=Zn2+,如果电解质为KCl,此反应锌的吸氧腐蚀,B极反应式为O2+2H2O+4e-=4OH-;(2)打开K1,闭合K2,此装置为电解池装置,A连接电源的负极,因此A为阴极,发生反应式为:2H2O-2e-=H2↑+OH-,出现的现象是有无色气体产生,且溶液变红;根据电解原理,阳离子向阴极移动,阴离子向阳极移动,即Na+向A极移动;B连接电源的正极,B极作阳极,因此反应式为2Cl--2e-=Cl2↑,两式相加得到:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;(3)精炼铜时,粗铜作阳极,纯铜作阴极,电解质溶液是含Cu2+,因此A极为纯铜,电极反应式为Cu2++2e-=Cu,粗铜中含有锌、铁等杂质,锌和铁先失电子,因此Cu2+的浓度减小。
2NaOH+H2↑+Cl2↑;(3)精炼铜时,粗铜作阳极,纯铜作阴极,电解质溶液是含Cu2+,因此A极为纯铜,电极反应式为Cu2++2e-=Cu,粗铜中含有锌、铁等杂质,锌和铁先失电子,因此Cu2+的浓度减小。


科目:高中化学 来源: 题型:
【题目】某兴趣小组设计出下图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。

(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c。其目的是_____________________________。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL浓硝酸。c中反应的化学方程式是____________________。再由a向c中加2 mL蒸馏水,c中的实验现象是 ___________________________。
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是_____________。理由是_____________。
方案 | 反应物 |
甲 | Cu、浓HNO3 |
乙 | Cu、稀HNO3 |
丙 | Cu、O2、稀HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化钙在2973 K时熔化,而NaCl在1074 K时熔化,二者的离子间距和晶体结构都类似,有关它们熔点差别较大的原因叙述不正确的是
A.氧化钙晶体中阴、阳离子所带电荷数多
B.氧化钙晶格能比氯化钠的晶格能大
C.两种晶体的晶胞结构类型不同
D.氧化钙、氯化钠的离子间距类似情况下,晶格能主要由阴、阳离子所带电荷数决定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,NOx和SO2是雾霾的主要成分。
Ⅰ.NOx主要来源于汽车尾气。
已知:N2(g)+O2(g)![]() 2NO(g) △H=+180.50 kJ·mol-1
2NO(g) △H=+180.50 kJ·mol-1
2CO(g)+O2(g)![]() 2 CO2(g) △H=-566.00kJ·mol-1
2 CO2(g) △H=-566.00kJ·mol-1
(1)为了减轻大气污染,人们提出在汽车尾气排气管口采用催化剂将NO和CO转化成无污染气体参与大气循环。写出该反应的热化学方程式_________________。
(2)T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0-15min)中NO的物质的量随时间变化的关系如右图所示。


①T℃时该化学反应的平衡常数K=_______________;平衡时若保持温度不变,再向容器中充入CO、N2各0.8mol,平衡将_______移动。(填“向左”、“向右”或“不)
②图中a、b分别表示在一定温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是__________(填“a”或“b”)。
③15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是_______。
Ⅱ.SO2主要来源于煤的燃烧。燃煤烟气的脱硫减排是减少大气中含硫化合物污染的关键。
(3)用纯碱溶液吸收SO2可将其转化为HSO3-。该反应的离子方程式是___________________。
(4)如图电解装置可将雾霾中的NO、SO2分别转化为NH4+和SO42-。物质A的化学式为_____________,阴极的电极反应式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室使用的浓盐酸的溶质质量分数为36.5%,密度为1.19 g·cm-3,则该盐酸的物质的量浓度是( )
A.11.9 B.11.9 mol·L-1 C.0.012 mol·L-1 D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知ΔH 表示反应热(ΔH>0表示吸热,ΔH<0表示放热),下列描述正确的是( )
A.伴随有能量变化的物质变化都是化学变化。
B.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同。
C.已知相同条件下2SO2(g)+O2(g)![]() 2SO3(g) ΔH1,反应2SO2(s)+O2(g)
2SO3(g) ΔH1,反应2SO2(s)+O2(g)![]() 2SO3(g) ΔH2,则ΔH1>ΔH2。
2SO3(g) ΔH2,则ΔH1>ΔH2。
D.在稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol,若将含0.5 mol H2SO4的浓H2SO4与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com