
【题目】ATP合成酶的合成是在
A. 线粒体中 B. 高尔基体中 C. 核糖体中 D. 内质网中
科目:高中化学 来源: 题型:
【题目】下列关于化石燃料的加工说法正确的是( )
A.煤干馏主要得到焦炭、煤焦油、粗氨水和焦炉气
B.石油裂化主要得到乙烯
C.石油分馏是化学变化,可得到汽油、煤油
D.煤的气化是在高温下煤和水蒸气作用转化为可燃性气体的过程,属于物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一定量有机物和足量Na反应得到![]() L氢气,取另一份等物质的量的同种有机物和足量NaHCO3反应得
L氢气,取另一份等物质的量的同种有机物和足量NaHCO3反应得![]() L二氧化碳,若在同温同压下
L二氧化碳,若在同温同压下![]() =
=![]() ≠0,则该有机物可能是
≠0,则该有机物可能是
①CH3CH(OH)COOH ②HOOC—COOH
③CH3CH2COOH④HOOCCH2CH(OH)CH2COOH ⑤CH3CH(OH)CH2OH
A. ② B. ②③④ C. 只有④ D. ①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法错误的是( )
A.CCl4可由CH4制得,可萃取碘水中的碘
B.石油和天然气的主要成分都是碳氢化合物
C.乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别
D.苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答:
(1)Fe2O3+2Al![]() Al2O3+2Fe,在该反应中________元素的化合价升高,该元素的原子____电子(得到或失去),_____________是氧化剂,______________是还原剂,________是还原产物,________是氧化产物。(填化学式)
Al2O3+2Fe,在该反应中________元素的化合价升高,该元素的原子____电子(得到或失去),_____________是氧化剂,______________是还原剂,________是还原产物,________是氧化产物。(填化学式)
(2)标出下列化合物中指定元素的化合价。
KMnO4中Mn元素的化合价__________,KClO3中Cl元素的化合价__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁铝碱式碳酸盐MgaAlb(OH)c(CO3)d·xH2O是一种不溶于水的新型无机阻燃剂,其受热分解产物中的MgO、Al2O3熔点较高且都不燃烧,有阻燃作用。
完成下列填空:
(1).组成镁铝碱式碳酸盐的三种非金属元素的原子半径从小到大的顺序是______________。碳原子最外层电子排布式是_______________________________,铝原子核外有_________种能量不同的电子。
(2).将MgaAlb(OH)c (CO3)d·x H2O表示成氧化物的形式:2aMgO·bAl2O3·2dCO2·((______))H2O;焦炭与石英高温下在氮气流中发生如下反应,工业上可由此制得一种新型陶瓷材料氮化硅(Si3N4) :3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+6CO(g) + Q (Q>0)
Si3N4(s)+6CO(g) + Q (Q>0)
(3).该反应中,氧化产物是________________________。若测得反应生成4.48 L CO气体(标准状况下),则转移的电子的物质的量为_____________。
(4).该反应的平衡常数表达式K=_____________________________;若升高温度,K值____________(填“增大”、“减小”或“不变”)。该反应的速率与反应时间的关系如图所示,t4时刻引起正逆速率变化的原因是___________________________(写出一种即可)。
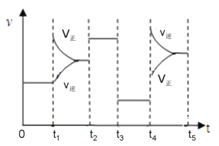
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气及其化合物在生产生活中有重要的应用。
(1)可用O2将HCl转化为Cl2:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。已知相关化学键的键能如下表所示
化学键 | H-Cl | O=O | Cl – Cl | H-O |
E(kJ·mol-1 | a | b | c | d |
则该反应的△H=______________。(用含a、b、c、d的代数式表示)
(2)氯气是有机合成中的重要试剂,丙烯(CH2=CHCH3)和Cl2在一定条件下发生如下反应: CH2=CHCH3 (g)+Cl2(g) ![]() CH2=CHCH2Cl(g)+HCl(g)。一定压强下,该反应在不同温度、不同投料比时,达平衡时Cl2的转化率如图所示(T12< T3)
CH2=CHCH2Cl(g)+HCl(g)。一定压强下,该反应在不同温度、不同投料比时,达平衡时Cl2的转化率如图所示(T12< T3)
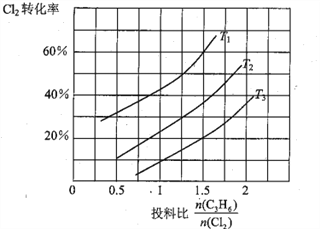
①该反应的△H______________0(填“>”或“<”)
②下列措施能增大丙烯的平衡转化率的是______________ (填标号)。
A.降低温度 B.减小容器的体积
C.使用新型催化剂 D.从容器中移走氯化氢
③T1时,在容积为5L的密闭容器中充入0.15mol丙烯和0.10 molCl2,10min时达到平衡,则v(Cl2)为______________mol·〔L·min)-1,平衡常数K为______________,保持温度不变,减小投料比![]() ,K值将______________ (填“增大”“减小”或“不变”);若起始时向该容器中充入0.30mol丙烯、0.20 molCl2、0.15 mol CH2=CHCH2Cl和0.30 molHCl,判断反应进行的方向并说明理由____________________________。
,K值将______________ (填“增大”“减小”或“不变”);若起始时向该容器中充入0.30mol丙烯、0.20 molCl2、0.15 mol CH2=CHCH2Cl和0.30 molHCl,判断反应进行的方向并说明理由____________________________。
④上述反应在低于某温度时,CH2=CHCH2Cl的产率快速下降,可能的原因是____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com