
【题目】一定条件下,a L密闭容器中放入1molN2和3molH2发生N2+3H2![]() 2NH3的反应,下列选项中能说明反应已达到平衡状态的是
2NH3的反应,下列选项中能说明反应已达到平衡状态的是
A.c(N2)∶c(H2)∶c(NH3)=1∶3∶2
B.2v(H2)=3v(NH3)
C.单位时间内1个N≡N键断裂的同时,有6个N-H键断裂
D.单位时间消耗0.1molN2的同时,生成0.2molNH3
【答案】C
【解析】
根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态。
A.c(N2)∶c(H2)∶c(NH3)=1∶3∶2,并不能说明浓度不变,所以不一定是平衡状态,选项A错误;
B、未体现正与逆的关系,选项B错误;
C、单位时间内1个N≡N键断裂,等效于6个N-H键形成,同时有6个N-H键断裂,所以正逆反应速率相等,反应达平衡状态,选项C正确;
D、只要反应发生就符合单位时间消耗0.1molN2的同时,生成0.2molNH3,选项D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】对于反应N2+3H2![]() 2NH3+Q(Q>0),下列判断正确的是( )
2NH3+Q(Q>0),下列判断正确的是( )
A.3体积H2和足量N2反应,必定生成2体积NH3
B.工业上采用氮氢循环操作的主要目的是提高N2和H2的利用率
C.500℃左右比室温更有利于向合成氨的方向进行
D.其他条件不变,减小压强,平衡必定向右移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是( )
A.100g98%的浓H2SO4中所含的氧原子数为4NA(NA为阿伏加德罗常数,下同)
B.3.1g白磷晶体中含有的P﹣P键数是0.6NA
C.向Ca(HCO3)2溶液中加入Ca(OH)2溶液至过量:Ca2++2HCO3﹣+2OH﹣═CaCO3↓+CO![]() +2H2O
+2H2O
D.冰水中常会形成(H2O)x(x≥1)分子,原因是存在氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予锂离子电池的发明者,LiFePO4是锂离子电池的正极材料。用含锂废渣(主要金属元素的含量:Li 8.50%、Ni 6.55%、Mg 13.24%)制备Li2C2O4,并用其制备LiFePO4部分工艺流程如图(该流程可能造成水体砷污染):
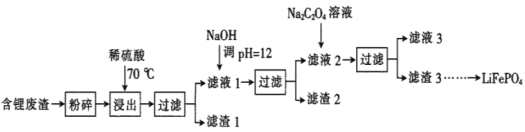
已知:滤液1、滤液2中部分离子的浓度(g·L-1):
Li+ | Ni2+ | Mg2+ | |
滤液1 | 22.72 | 20.68 | 60.18 |
滤液2 | 21.94 | 7.7×10-3 | 0.78×10-3 |
I.制备Li2C2O4
(1)滤渣2的主要成分有__(填化学式)。
(2)Na2C2O4溶液中各离子的浓度由大到小顺序为__。
(3)写出加入Na2C2O4溶液时发生反应的离子方程式:__。
Ⅱ.制备LiFePO4
(4)将电池极Li2C2O4和FePO4置于高温下反应生成LiFePO4和一种温室气体,该反应的化学方程式是___。
(5)LiFePO4需要在高温下成型后才能作为电极,高温成型时要加入少量石墨,则石墨的作用是__(任写一点)。
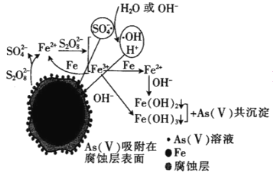
(6)我国科学家研究零价铁活化过硫酸钠(Na2S2O8)去除废水中的As(Ⅴ),其机制模型如图,其中零价铁与过硫酸钠反应的离子方程式是__。在该模型中得到的铁砷共沉淀物经灼烧(无元素化合价变化)后得到一种磁性化合物,化学式为Fe7As2O14,该物质中二价铁与三价铁的个数比为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛被称为继铁、铝之后的第三金属,其单质及化合物在航天、军事、航海、医疗等领域都有着重要的应用。请回答下列问题:
(1)在元素周期表中,锆元素与钛元素同族,则锆元素位于__区。
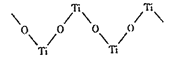
(2)TiO2能溶于浓硫酸并析出一种离子晶体,已知其中阳离子是以链状聚合物形成存在的钛酰阳离子,其结构如图所示,若阳离子所带电荷为+n,则该离子中钛原子数为__。
(3)超高导热绝缘耐高温纳米氮化铝在绝缘材料中应用广泛,氮化铝晶体与金刚石类似,每个Al原子与__个N原子相连,与同一个N原子相连的Al原子构成的立体构型为___,氮化铝晶体属于___晶体。
(4)Ti3+可形成配位数为6的两种配合物晶体(一种是紫色,一种是绿色),组成皆为TiCl36H2O。向含有0.01mol绿色配合物晶体的水溶液中加入过量硝酸银溶液,产生0.02molAgCl沉淀,则绿色配合物晶体的化学式为__。
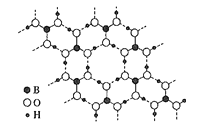
(5)硼与铝同族,硼酸晶体是片层结构,其中一层的结构如图所示,层内的分子以氢键相连。含1mol硼酸的晶体中有__mol氢键。图中所示最外层已达8原子结构的原子是__(填元素符号),H3BO3晶体中B原子个数与极性键个数比为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯氧布洛芬具有良好的解热、镇痛、抗炎、抗风湿作用,苯氧布洛芬的合成路线如下:
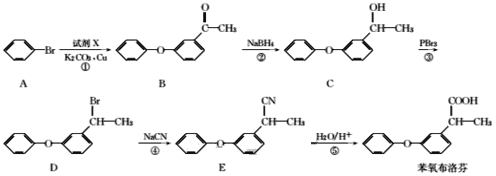
回答下列问题:
(1)苯氧布洛芬中官能团的名称为___。
(2)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。A-D四种物质中,含有手性碳的有机物为___(填字母)。
(3)反应②的反应类型是___。
(4)若过程①发生的是取代反应,且另一种产物为HBr,由A生成B发生反应的化学方程式为___。
(5)有机物M与C互为同分异构体,M满足下列条件:
I.能与FeCl3溶液发生显色反应,1molM可消耗2molNaOH;
Ⅱ.M分子中有6种不同化学环境的氢,核磁共振氢谱为3:2:2:2:2:3,且分子中含有![]() 结构。
结构。
M的结构有___种,写出其中一种结构简式:___。
(6)根据已有知识并结合相关信息,写出以丙酮(CH3COCH3)为原料制备2一甲基丙酸的合成路线流程图(无机试剂任用)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高能LiFePO4电池多应用于公共交通,结构如图所示。电池中间是聚合物的隔膜,其主要作用是在反应过程中只让Li+通过,原理如下:(1x)LiFePO4+xFePO4+LixCn![]() LiFePO4+nC。下列说法错误的是( )
LiFePO4+nC。下列说法错误的是( )

A.放电时,Li+向正极移动
B.放电时,电子由负极→用电器→正极
C.充电时,阴极反应为xLi++nC+xe-=LixCn
D.充电时,阳极质量增重
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠和铜的单质及其化合物在社会实际中有着广泛的应用。
(1)NaCl晶体的晶胞结构如图所示,每个NaCl的晶胞中含有的阴离子的个数为__,阳离子周围最近且等距离得阴离子的个数为__。
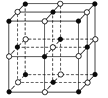
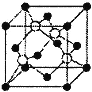
(2)碘化钠溶液和硫酸铜溶液能反应生成一种铜的碘化物A(白色沉淀),A的晶胞如右图所示,则A的化学式是__,A中铜元素的化合价为__。
(3)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,再滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4·H2O沉淀,该物质中的NH3通过___键与中心离子Cu2+结合,NH3分子中N原子的杂化方式是__。与NH3分子互为等电子体的一种阳离子是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如下图所示的装置,模拟工业用含硫废水生产Na2S2O3·5H2O的过程。

锥形瓶C中发生反应:
①Na2S+H2O+SO2→Na2SO3+S
②2H2S+SO2→3S↓+2H2O
③S+Na2SO3![]() Na2S2O3
Na2S2O3
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若__________________,则整个装置气密性良好。装置D的作用是_________。装置E中为_________溶液。
(2)装置B可用于观察SO2的生成速率,其中的液体最好选择_________。
a.饱和食盐水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
锥形瓶C的溶液中含有Na2S和过量的Na2SO3.已知反应③的速率是三个反应中最慢的,则锥形瓶C中反应达到终点的现象是__________。
(3)反应结束后,锥形瓶C的溶液中除含Na2S2O3,还可能含Na2SO3、Na2SO4等杂质。用所给试剂设计实验,检测锥形瓶C的溶液中是否存在Na2SO4(供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液)简要说明实验操作,现象和结论:_________________。
(4)实验前锥形瓶C溶液中含有0.08molNa2S和0.04molNa2SO3,反应结束后经一系列操作,得到纯净的Na2S2O3·5H2O晶体19.11g,则Na2S2O3·5H2O产率是_________(Na2S2O3·5H2O式量248)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com