
【题目】下列说法错误的是
A.在共价化合物中一定含有共价键
B.含有共价键的化合物一定是共价化合物
C.含有离子键的化合物一定是离子化合物
D.全部由非金属组成的化合物可能是离子化合物
科目:高中化学 来源: 题型:
【题目】浓度为2.00 mol/L的盐酸溶液1L,欲使其浓度变为4.00mol/L,下列方法可行的是( )
A. 蒸发掉0.5L水 B. 标况下通入44.8L HCl气体
C. 将溶液加热蒸发浓缩至0.5L D. 加入10mol/L盐酸0.6L,再将溶液稀释至2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学物质分类知识,回答下列问题。有下列10种物质
①CH3CH2CH3 ②CH2==CH2 ③![]() ④
④ ![]() ⑤CH3CH2CH2OH ⑥CH3CHO ⑦CuSO4·5H2O ⑧Fe ⑨CH3COOH ⑩CH3COONa
⑤CH3CH2CH2OH ⑥CH3CHO ⑦CuSO4·5H2O ⑧Fe ⑨CH3COOH ⑩CH3COONa
(1)属于无机化合物的是 _______。
(2)属于烃的是_______。
(3)属于烷烃的是______,属于酸的是______。
(4)属于有机化合物的是_______ 。属于烃的衍生物的是_______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:N2(g)+O2(g)![]() 2NO(g),△H=+180.50 kJ·mol-1;△S=247.7 J·mol-1·K-1。若该反应在一密闭容器中进行,若不考虑温度对该反应焓变的影响,则下列说法中正确的是( )
2NO(g),△H=+180.50 kJ·mol-1;△S=247.7 J·mol-1·K-1。若该反应在一密闭容器中进行,若不考虑温度对该反应焓变的影响,则下列说法中正确的是( )
A. 能使该反应物中活化分子数和活化分子百分数同时增大的方法只能是使用催化剂
B. 到达平衡状态时,v(N2)=2v(NO)
C. 在1000℃时,此反应能自发进行
D. 一定温度下,该反应达到平衡状态后,增加N2的浓度,化学反应平衡常数变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的恒容容器中,充入1molA和3molB,并在一定条件下发生反应:A(g)+3B(g)![]() 2C(g);经3s后达到平衡,测得C气体的浓度为0.6 mol·L-1,下列说法中不正确的是( )
2C(g);经3s后达到平衡,测得C气体的浓度为0.6 mol·L-1,下列说法中不正确的是( )
A. 用B表示反应速率为0.3 mol·L-1·s-1
B. 平衡后,向容器中充入无关气体(如Ne),反应速率增大
C. 3s时生成C的物质的量为1.2mol
D. 平衡后,v(正)(A)=v(逆)(A)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25 ℃、1.01×105 Pa下,1mol氢气在氧气中燃烧生成气态水的能量变化如下图所示,下列有关说法正确的是( )
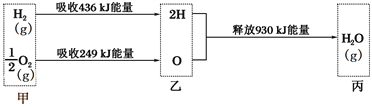
A. H2O分解为H2与O2时放出热量
B. 热化学方程式为:2H2(g) + O2(g) = 2H2O(g) ΔH = -490 kJ·mol-1
C. 甲、乙、丙中物质所具有的总能量大小关系为甲>乙>丙
D. 乙→丙的过程中若生成液态水,释放的能量将小于930 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】假设图中原电池产生的电压、电流强度均能满足电解、电镀要求,即为理想化。①~⑧为各装置中的电极编号。当K闭合后,下列说法正确的有( )
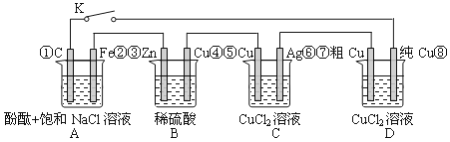
①D装置中纯Cu电极反应为:Cu2++2e-=Cu
②整个电路中电子的流动方向为:③→②;①→⑧;⑦→⑥;⑤→④;
③C装置原理上是一个电镀池(Ag表面镀Cu),期中Cu作阴极,Ag作阳极
④A装置中C电极反应为:O2+4e-+2H2O=4OH-
A. ③④ B. ①② C. ②③④ D. ①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设C+CO2==2CO-Q1,反应速率为v1;N2+3H2==2NH3+Q2,反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况为
A.同时减小B.同时增大C.v1增大,v2减小D.v1减小,v2增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢叠氮酸(HN3)和莫尔盐(NH4)2SO4·FeSO4·6H2O是两种常用原料。
(1)氨叠氮酸易溶于水,25℃时,该酸的电离常数为Ka=10×10-5
①氢叠氮酸在水溶液中的电离方程式为________________________________
②0.2mol/L的HN3溶液与0.1mol/L的NaOH溶液等体积混合后,恢复到25℃,混合溶液中各离子和HN3分子浓度由大到小的顺序为__________________________。
③已知T℃时,Ksp(CuN3)=5.0×10-9,Ksp(Cu2S)=2.5×10-48,则相同温度下,2CuN3(s)+S2-(aq)![]() Cu2S(s)+2N3-(aq)该反应正反应方向_________(“能”或“不能”)进行基本彻底,请通过计算说明_________________________。
Cu2S(s)+2N3-(aq)该反应正反应方向_________(“能”或“不能”)进行基本彻底,请通过计算说明_________________________。
(2)在FeSO4溶液中,加入(NH4)2SO4固体可制备莫尔盐晶体,为了测定产品纯度,称取ag产品溶于水,配制成500mL溶液,用浓度为cmol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如下:(已知莫尔盐的分子量为392)
实验次数 | 第一次 | 第二次 | 第三次 |
消耗KMnO4溶液体积/mL | 25.52 | 25.02 | 24.98 |
滴定终点的现象是________________,通过实验数据,计算该产品的纯度为_________(用含字母a、c的式子表示)。上表第一次实验中记录数据明显大于后两次,其原因可能是_________。
A.第一次滴定时,锥形瓶用待装液润洗
B.该酸性高锰酸钾标准液保存时间过长,部分变质
C.滴定前酸式滴定管中尖嘴处有气泡,滴定结束后气泡消失
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com