
【题目】亮菌甲素(图 a) 用于急性胆囊炎、慢性胆囊炎发作、其他胆道疾病并发急性感染及慢性浅表性胃炎、萎缩性胃炎, 配以辅料丙二醇溶成针剂用于临床。若使用廉价的二甘醇(图 b) 作为辅料, 会使人中毒。下列说法正确的是
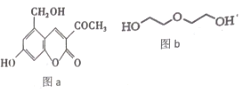
A.l mol 亮菌甲素与溴水混合,最多消耗Br2 4 mol
B.亮菌甲素中所有的碳原子不可能共平面
C.l mol 亮菌甲素反应最多消耗 5molH2或2molNaOH
D.等物质的量的丙二醇和二甘醇充分燃烧消耗的氧气量不相同
【答案】D
【解析】
A.亮菌甲素中含有碳碳双键和酚羟基,酚羟基的邻位和对位可与溴发生取代,该物质结构中,酚羟基对位无氢原子,不能与溴取代,l mol 亮菌甲素与溴水混合,最多消耗Br2 3mol,故A错误;
B.苯环上的碳原子在同一平面,与碳碳双键直接相连的碳原子在同一平面,则苯环与碳碳双键在同一平面,甲基和亚甲基可能与苯环在同一平面,则该有机物中所有的碳原子可能在同一平面,故B错误;
C.亮菌甲素中含有碳碳双键、酮羰基和苯环,l mol 亮菌甲素反应最多消耗 5molH2,亮菌甲素中含有酚羟基和酯基,酚羟基具有酸性,可与氢氧化钠反应,该有机物的酯基水解后形成酚羟基和羧基都可与氢氧化钠反应,故l mol 亮菌甲素反应最多消耗3molNaOH,故C错误;
D.丙二醇(HOCH2CH2OH)的分子式为C2H6O2,可以看成C2H22H2O的形式,二甘醇(HOCH2CH2OCH2CH2OH)的分子式为C4H10O3,可看成C4H43H2O的形式,当物质的量相等的情况下,耗氧量不同,故D正确;
答案选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列叙述正确的是( )
A.1mol碳正离子(CH3+)所含的电子总数为9NA
B.25℃,pH=13的Ba(OH)2 溶液中含有OH-的数目为0.1NA
C.常温常压下,过氧化钠与水反应时,生成8g氧气转移的电子数为0.5NA
D.1mol雄黄(As4S4),结构如图:![]() ,含有2NA个S-S键
,含有2NA个S-S键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是三种难溶金属硫化物的溶度积常数(25℃):
化学式 | FeS | CuS | MnS |
溶度积 | 6.3×10-18 mol2·L-2 | 1.3×10-36 mol2·L-2 | 2.5×10-13 mol2·L-2 |
下列有关说法中正确的是
A.25℃时,CuS 的溶解度大于 MnS 的溶解度
B.除去某溶液中的 Cu2+,可以选用 FeS 作沉淀剂
C.因为 H2SO4 是强酸,所以反应 CuSO4+H2S = CuS↓+H2SO4不能发生
D.25℃时,饱和 CuS 溶液中,Cu2+的浓度为 1.3×10-36 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组为了分析补血剂 FeSO4·7H2O 中铁元素的质量分数,用 KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO4- +8H+= 5Fe3++Mn2++4H2O。
(1)实验前,首先要精确配制一定物质的量浓度的 KMnO4 溶液 250 mL,配制时需要用的仪器除天平、药匙、玻璃棒、烧杯、胶头滴管外,还需____________。
(2)滴定前是否要滴加指示剂?_____(填“是”或“否”),理由是_____。
(3)某同学设计的下列滴定方式中,最合理的是_____(填序号)
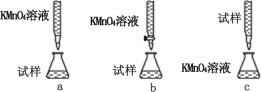
(4)该实验小组称取 12.0 g 补血剂在容量瓶中配成 100 mL 溶液,量取 25.00 mL 试样溶液, 用 0.100 mol·L-1 KMnO4标准溶液滴定。 达到滴定终点时, 消耗标准溶液20.00 mL,则所测补血剂中铁元素的质量分数是_____(精确至 0.01%)。
(5)若该小组配制溶液和滴定操作时引起的误差忽略,最终所测补血剂中铁元素含量 仍偏小,其可能原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气与氧气构成的碱性燃料电池原理如图所示,下列说法正确的是
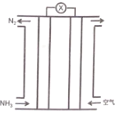
A.电解质溶液中电子移向正极
B.电池负极反应为:2NH3-6e-=N2+6H+
C.正负极通入的气体在相同条件下体积之比为15: 4 (假设空气中O2体积分数为20%)
D.该电池给铅蓄电池充电,燃料电池正极反应l molO2,铅蓄电池有2mol PbSO4被消耗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以经预处理的废旧磷酸亚铁锂电极(主要成分为LiFePO4、 Al、C)为原料,生产Li2CO3 的部分工艺流程如下:
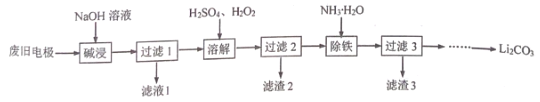
已知:LiFePO4难溶于水和碱性溶液,可溶于酸性溶液。Li2CO3溶于稀酸,微溶于水。下列说法不正确的是
A.滤渣2的主要成分为C
B.溶解时发生反应的离子反应方程式:2LiFePO4+2H++H2O2=2Li++2Fe3++ 2![]() + 2H2O
+ 2H2O
C.向过滤3的滤液中加入饱和Na2CO3溶液即可生成Li2CO3沉淀
D.已知将Li2CO3、FePO4x H2O、H2C2O4 混合反应可重新获得LiFePO4,理论上完全反应消耗的n(Li2CO3):n(FePO4x H2O):n(H2C2O4)=1:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:化合物A 和 B 均是由四种短周期元索组成的离子化合物, 且阳离子相同,A中阴阳离子个数比为1 : 1;气体甲由三种元素组成,标况下密度为2.68gL-1 ,且分子中各原子最外层电子满足8 电子 ;乙和丙为'常见气体,均能使澄清石灰水变浑浊,丙能使品红溶液褪色;气体丁能使湿润的红色石蕊试纸变蓝。化合物A 按如下流程进行实验。
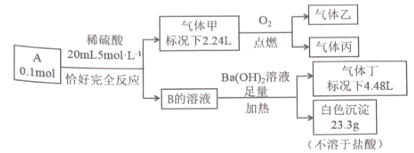
请回答
(1)气体甲的电子式 ______________。
(2)气体丙通入足量硝酸钡溶液中,发生反应的离子方程式为____________。
(3)检验A的水溶液中所含阴离子的实验方法为_________________。
(4)气体甲和气体丙在一定条件下 ________(填 “可能” 或“不可能”) 发生氧化还原反应,若可能请写出你认为合理的化学方程式,若不可能请说明你的理由________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳族元素的单质和化合物具有非常重要的作用。请回答下列问题。
(1)碳族元素中最早用于制造半导体器件的是__(填元素名称),其价电子排布式为___。
(2)CH3OH分子中C原子的杂化方式为__,SCN-的空间构型为___。
(3)①烷烃(CnH2n+2)随n的增大其熔沸点升高,原因是__。
②硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都很少,原因是__。
(4)如图是SiO2晶胞,构成二氧化硅晶体结构的最小环是由__个原子构成。已知晶胞参数为apm,则其晶胞密度为__g·cm-3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NaCl和CuSO4两种溶液等体积混合后用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图所示,则下列说法正确的是

A.整个过程中两电极反应2Cl--2e-=Cl2↑、2H+2e-=H2↑不可能同时发生
B.电解至C点时,往电解质溶液中加入适量CuCl2固体,即可使电解质溶液恢复至原来的浓度
C.AB段表示电解过程中H+被还原,pH增大
D.原混合溶液中NaCl和CuSO4浓度之比恰好为2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com