
【题目】氨气与氧气构成的碱性燃料电池原理如图所示,下列说法正确的是
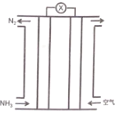
A.电解质溶液中电子移向正极
B.电池负极反应为:2NH3-6e-=N2+6H+
C.正负极通入的气体在相同条件下体积之比为15: 4 (假设空气中O2体积分数为20%)
D.该电池给铅蓄电池充电,燃料电池正极反应l molO2,铅蓄电池有2mol PbSO4被消耗
【答案】C
【解析】
该电池为燃料电池,通入氧气的一端为正极,通入氨气的一端为负极,根据图示,电池总反应为4NH3+3O2=2N2+6H2O。
A.电子只能在导体中转移,不能在溶液中转移,故A错误;
B.氨气与氧气构成的碱性燃料电池,不可能产生氢离子,电池负极反应为: 2NH3-6e-+6OH-=N2+6H2O,故B错误;
C.根据分析,投入空气的一端为正极,通入氨气的一端为负极,相同条件下,气体体积之比等于物质的量之比,电池总反应为4NH3+3O2=2N2+6H2O,当负极通入4mol氨气时,正极消耗3mol氧气,则需要空气的量为![]() =15mol,则正负极通入的气体在相同条件下体积之比为15 : 4,故C正确;
=15mol,则正负极通入的气体在相同条件下体积之比为15 : 4,故C正确;
D.该电池给铅蓄电池充电,燃料电池正极反应l molO2,转移4mol电子,充电时铅蓄电池阴极反应为:PbSO4+2e-=Pb+SO42-,阳极反应为:PbSO4-2e-+2H2O=PbO2+4H++SO42-,铅蓄电池两极都消耗PbSO4,转移4mol电子时,铅蓄电池共消耗了4mol PbSO4,故D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用硫酸铁溶液与铜粉反应,又向反应后溶液中加入KSCN溶液以检验Fe3+是否有剩余,实验记录如下;
实验编号 | 操作 | 现象 |
实验1 |
| i.加入Cu粉后充分振荡,溶液逐渐变蓝; ii.取少量i中清液于试管中,滴加2滴 0.2mol/LKSCN溶液,溶液变为红色,但振荡后红色迅速褪去并有白色沉淀生成。 |
(1)写出实验1中第i步的离子方程式_______________。甲同学猜想第ii步出现的异常现象是由于溶液中的Cu2+干扰了检验Fe3+的现象。查阅相关资料如下
①2Cu2++4SCN- ![]() 2CuSCN↓(白色)+(SCN)2(黄色)
2CuSCN↓(白色)+(SCN)2(黄色)
②硫氰[(SCN)2]:是一种拟卤素,性质与卤素单质相似,其氧化性介于Br2和I2之间。
该同学又通过如下实验验证猜想
实验编号 | 操作 | 现象 |
实验2 |
| 溶液呈绿色,一段时间后后开始出现白色沉淀,上层溶液变为黄色 |
实验3 |
| 无色溶液立即变红,同时生成白色沉淀。 |
(2)经检测,实验2反应后的溶液pH值减小,可能的原因是___________________________________________。
(3)根据实验2、3的实验现象,甲同学推断实验3中溶液变红是由于Fe2+被(SCN)2氧化,写出溶液变红的离子方程式_______________________。继续将实验2中的浊液进一步处理,验证了这一结论的可能性。

补充实验4的目的是排除了溶液存在Cu2+的可能,对应的现象是____________________________________________。
(4)乙同学同时认为,根据氧化还原反应原理,在此条件下,Cu2+也能氧化Fe2+,他的判断依据是_______。
(5)为排除干扰,小组同学重新设计如下装置。
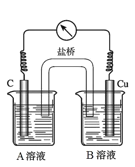
①A溶液为____________________________。
②“电流表指针偏转,说明Cu与Fe3+发生了反应”,你认为这种说法是否合理?__________________(填合理或不合理),原因是__________________________________________。
③验证Fe3+是否参与反应的操作是________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原子核外电子的描述正确的是
A.s 能级的能量总小于 p 能级的能量
B.2s 的电子云半径比 1s 电子云半径大,说明 2s 的电子比 1s 的多
C.基态铜原子的价电子轨道表示式为 ![]()
D.nf 能级中最多可容纳 14 个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用 R代表)。 回答下列问题:
(1)基态氮原子价层电子的轨道表示式为_____。
(2)氯离子的基态电子排布式为_____,有_____种不同能级的电子。
(3)R 中 H、N、O 三种元素的电负性由大到小的顺序是_____(用元素符号表示)。
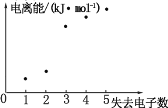
(4)如图表示短周期元素 X 的基态原子失去电子数与对应电离能的关系,试推测 X 与R 中的_____(填元素符号)元素同周期。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.C60 和 C70互为同位素
B.N2 、N3- 、N4、N5+互为同素异形体
C.立方烷(![]() )和苯乙烯互为同分异构体
)和苯乙烯互为同分异构体
D.CH3CH2COOH 和HCOOCH2CH2CH3 互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亮菌甲素(图 a) 用于急性胆囊炎、慢性胆囊炎发作、其他胆道疾病并发急性感染及慢性浅表性胃炎、萎缩性胃炎, 配以辅料丙二醇溶成针剂用于临床。若使用廉价的二甘醇(图 b) 作为辅料, 会使人中毒。下列说法正确的是
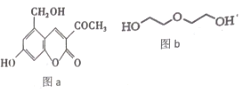
A.l mol 亮菌甲素与溴水混合,最多消耗Br2 4 mol
B.亮菌甲素中所有的碳原子不可能共平面
C.l mol 亮菌甲素反应最多消耗 5molH2或2molNaOH
D.等物质的量的丙二醇和二甘醇充分燃烧消耗的氧气量不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年诺贝尔化学奖授予借助某些金属离子制造出复杂新分子,从而合成分子机器的三位科学家,合成新分子过程模拟如下:

下列有关信息错误的是( )
A.图中新月形分子和环状分子“组合”在一起,铜离子起关键作用
B.利用此方式可以合成新分子,同时也可能创造一种全新“机械键”
C.在创造新分子技术中,铜离子不是唯一可以借助的金属离子
D.此技术不可以“互锁”合成![]() 分子,甚至成更复杂的分子
分子,甚至成更复杂的分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A和B的相对分子质量都小于200,完全燃烧时只生成CO2和H2O。B燃烧时消耗的氧气与生成的二氧化碳的物质的量相等。B中碳、氢元素总的质量分数为46.67%。B不发生银镜反应,但跟NaHCO3溶液反应放出CO2。1molA水解生成1mol苯甲酸和1molB。A溶液具有酸性,但遇FeCl3溶液不显色。
(1)A与B相对分子质量之差为___。
(2)B分子中应有___个氧原子。
(3)A的结构简式为___或___。
(4)写出B的属于酯的四种同分异构体的结构简式___、___、___、___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第VA族元素在生产、生活中有重要用途。回答下列问题:
(1)三聚磷酸钠(俗称“五钠”常用于食品生产中,作水分保持剂、品质改良剂等。
①磷酸的结构式如图所示,其主要的电离方程式为______________。
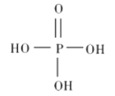
②三聚磷酸是三分子磷酸脱去两分子水后的产物,三聚磷酸钠的化学式为_______________。
(2)在碱性条件下,次磷酸盐(H2PO2-)可用于化学镀银,写出其反应的离子方程式______________。(氧化产物与还原产物物质的量之比为1:4)
(3)由工业白磷(含少量砷、铁、镁等)制备高纯白磷(熔点44℃,沸点280℃),主要生产流程如下:
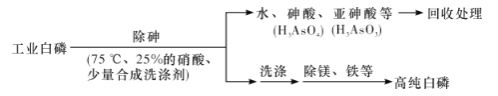
①除砷过程在75 ℃下进行,其合理的原因是____________(填字母代号)。
a,使白磷熔化,并溶于水 b.降低白磷的毒性
c.温度不宜过高,防止硝酸分解 d.适当提高温度,增大反应速率
②硝酸氧化除砷时被还原为NO,写出砷转化为亚砷酸的化学方程式:______________________________。
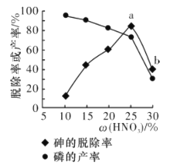
③某条件下,用一定量的硝酸处理一定量的工业白磷,砷的脱除率及磷的产率随硝酸质量分数的变化如图所示,砷的脱除率从a点到b点降低的原因是__________________。
(4)常温下银氨溶液中存在平衡:Ag+(aq) + 2NH3(aq) ![]() Ag(NH3)2+(aq),K=l.10×107 ;已知常温下Ksp(AgCl)=1.45×10-10计算可逆反应AgCl(s) +2NH3(aq)
Ag(NH3)2+(aq),K=l.10×107 ;已知常温下Ksp(AgCl)=1.45×10-10计算可逆反应AgCl(s) +2NH3(aq)![]() Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=_________(保留2位有效数字)。1L1mol/L氨水中最多可以溶解AgCl ______mol(保留1位有效数字)。
Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=_________(保留2位有效数字)。1L1mol/L氨水中最多可以溶解AgCl ______mol(保留1位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com