
【题目】以经预处理的废旧磷酸亚铁锂电极(主要成分为LiFePO4、 Al、C)为原料,生产Li2CO3 的部分工艺流程如下:
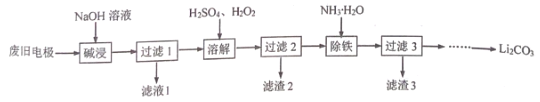
已知:LiFePO4难溶于水和碱性溶液,可溶于酸性溶液。Li2CO3溶于稀酸,微溶于水。下列说法不正确的是
A.滤渣2的主要成分为C
B.溶解时发生反应的离子反应方程式:2LiFePO4+2H++H2O2=2Li++2Fe3++ 2![]() + 2H2O
+ 2H2O
C.向过滤3的滤液中加入饱和Na2CO3溶液即可生成Li2CO3沉淀
D.已知将Li2CO3、FePO4x H2O、H2C2O4 混合反应可重新获得LiFePO4,理论上完全反应消耗的n(Li2CO3):n(FePO4x H2O):n(H2C2O4)=1:2:1
【答案】B
【解析】
根据流程:废旧磷酸亚铁锂电极(主要成分为LiFePO4、Al、C)用NaOH溶液碱浸:2Al+2OH-+2H2O═2AlO2-+3H2↑,过滤,滤渣为LiFePO4、C,加入稀硫酸、过氧化氢溶 2LiFePO4+4H2SO4+H2O2═Li2SO4+Fe2(SO4)3+2H3PO4+2H2O,C不溶,过滤除去,滤渣2为C;向滤液中加入氨水将Fe3+沉淀为Fe(OH)3,过滤,滤渣3为Fe(OH)3,向过滤3的滤液中加入饱和Na2CO3溶液可生成Li2CO3沉淀,据此分析作答。
A.根据上述分析,滤渣2的主要成分为C,故A正确;
B.溶解时的反应为LiFePO4与稀硫酸、过氧化氢反应,化学方程式为:2LiFePO4+4H2SO4+H2O2═Li2SO4+Fe2(SO4)3+2H3PO4+2H2O,离子反应为:2LiFePO4+8H++H2O2=2Li++2Fe3++2H3PO4+ 2H2O,故B错误;
C.根据分析,向过滤3的滤液中加入饱和Na2CO3溶液即可生成Li2CO3沉淀,故C正确;
D.已知将Li2CO3、FePO4x H2O、H2C2O4 混合反应可重新获得LiFePO4,反应为:Li2CO3+2FePO4xH2O+H2C2O4=2LiFePO4+3CO2↑+(2x+1)H2O,理论上完全反应消耗的n(Li2CO3):n(FePO4x H2O):n(H2C2O4)=1:2:1,故D正确;
答案选B。


科目:高中化学 来源: 题型:
【题目】利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g)![]() CH3OH(g),在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
CH3OH(g),在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是

A. 该反应的△H<0,且p1<p2
B. 反应速率:ν逆(状态A)>ν逆(状态B)
C. 在C点时,CO转化率为75%
D. 在恒温恒压条件下向密闭容器中充入不同量的CH3OH,达平衡时CH3OH的体积分数也不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置能达到实验目的的是( )
A.探究AgCl和AgI之间的转化 
B.比较Cl2、Br2、I2的氧化性强弱 ![]()
C.制备Fe(OH)2 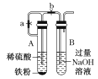
D.用已知浓度的氢氧化钠溶液测定盐酸浓度的实验 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊二烯之(![]() ) 是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产,根据能量循环图和表格中的键能,下列说法正确的是
) 是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产,根据能量循环图和表格中的键能,下列说法正确的是
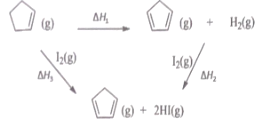
共价键 | 键能/ |
H-H | 436 |
H-I | 299 |
I-I | 151 |
A.△H1+△H2+△H3=0
B.△H1<△H3
C.![]() (g)转化为
(g)转化为![]() (g)的过程中,有C-H的断裂和形成
(g)的过程中,有C-H的断裂和形成
D.在相同条件下,生成 2molHCl(g) 的△H2′<△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亮菌甲素(图 a) 用于急性胆囊炎、慢性胆囊炎发作、其他胆道疾病并发急性感染及慢性浅表性胃炎、萎缩性胃炎, 配以辅料丙二醇溶成针剂用于临床。若使用廉价的二甘醇(图 b) 作为辅料, 会使人中毒。下列说法正确的是
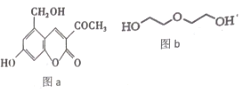
A.l mol 亮菌甲素与溴水混合,最多消耗Br2 4 mol
B.亮菌甲素中所有的碳原子不可能共平面
C.l mol 亮菌甲素反应最多消耗 5molH2或2molNaOH
D.等物质的量的丙二醇和二甘醇充分燃烧消耗的氧气量不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水醋酸镁为白色粉末,易潮解,易溶于水,熔点323℃,熔融时同时分解,常用作烯烃聚合催化剂,制备方法如下。
制法一:将80%醋酸用水稀释后,水浴加热至60~ 80℃,在搅拌下分批少量加入碳酸镁至CO2不再逸出为止,继续加热,趁热过滤。在滤液中补充适量醋酸,......,得到四水醋酸镁晶体,....,.即得无水醋酸镁
(1)碳酸镁需分批少量加入,理由是____________________。
(2)滤液中补充适量醋酸的目的是_____________________。
(3)从下列提供的操作中选择必要的操作(可重复使用),将制法一中“……”处的步骤补充完整,正确的顺序是 _________,_______。 (填编号)
制法二 :将六水硝酸镁与醋酸酐混合加热,发生反应:(具体步骤略去)
2Mg(NO3)26H2O+ 14(CH3CO )2O![]() 2Mg(CH3COO )2+ 4NO 2↑+ O2↑+24CH3COOH
2Mg(CH3COO )2+ 4NO 2↑+ O2↑+24CH3COOH
(4)用七水硫酸镁代替六水硝酸镁按相同操作进行制备实验,无法得到产品,原因是 __________________。
(5)以铬黑T(BET)为指示剂 ,用 EDTA测定Mg2+含量的原理用方程式可表示为:
EDTA (无色)+Mg-BET (紫红)= BET (蓝色)+ Mg-EDTA (无色)
为测定产品纯度,称取试样0.3000 g 于锥形瓶中,加入100ml 蒸馏水,待完全溶解后加入l 0mLpH=l 0的氨-氯化铁缓冲溶液,溶液变浑浊,再滴加3~ 4 滴铬黑 T 指示剂 (BET),用0. l 000molL-1 的 EDTA标准溶液滴定至终点,重复上述操作两次平均消耗 EDTA 标准溶液 20.50mL。
①滴定终点的现象为_______________ 。
②产品中镁元素的质量分数为________(保留四位有效数字)。
(6)下列关于该实验的操作或分析 ,正确的是__________(填编号)。
A. 用倾析法将固液混合物转移至布氏漏斗中进行抽滤时,先转移溶液再转移沉淀
B. 称取一定质量的产品时,若电子天平未调整水平,则称得的产品偏多
C. 开始滴定前,滴定管尖悬挂的液滴需擦去,否则可能引起结果偏低
D. 根据(5)的测定方法可知,Mg(OH)2可溶于EDTA溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X是某药物的中间体,其结构简式如图所示。下列有关X的说法正确的是( )

A.X的分子式为C27H27O10N
B.与足量H2发生加成反应后,该分子中官能团的种类减少1种
C.一定条件下,X能与乙醇发生酯化反应
D.1mol化合物X最多可与3molNaOH、8molH2发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于![]() 溶液,下列各项中正确的是
溶液,下列各项中正确的是![]()
![]()
A.![]()
B.水解离子方程式:CH3COO-+H2O![]() CH3COOH+OH-
CH3COOH+OH-
C.升高温度,水解平衡逆向移动
D.向溶液中加入少量醋酸钠固体,平衡正向移动,醋酸钠的水解程度![]() 即转化率
即转化率![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯MnCO3是广泛用于电子行业的强磁性材料。MnCO3为白色粉末,不溶于水和乙醇(沸点78.5 ℃),在潮湿环境下易被氧化,温度高于100 ℃开始分解。
I.实验室以MnO2为原料制备MnCO3
(1)制备MnSO4溶液:
①主要反应装置如图所示,缓缓通入经N2稀释的SO2气体,发生反应H2SO3 + MnO2=MnSO4+H2O。下列措施中,目的是加快化学反应速率的是________(填字母代号)。
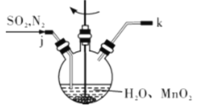
A. MnO2加入前先研磨 B.搅拌 C.提高混合气中N2比例
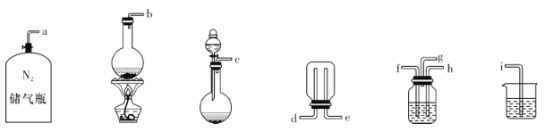
②已知实验室制取SO2的原理是Na2SO3 +2H2SO4(浓)=2NaHSO4+SO2↑+H2O。选择下图所示部分装置与上图装置相连制备MnSO4溶液,应选择的装置的接口顺序为_________(用箭头连接字母代号表示)。
③若用空气代替N2进行实验,缺点是_______________。( 酸性环境下Mn2+不易被氧化)
(2)制备MnCO3固体:
实验步骤:
①向MnSO4溶液中边搅拌边加入饱和NH4HCO3溶液生成MnCO3沉淀,反应结束后过滤;
②...;.
③在70~80℃下烘干得到纯净干燥的MnCO3固体。
步骤②为__________,需要用到的试剂有_____________、_______、________。
II.设计实验方案
(3)利用沉淀转化的方法证明Ksp(MnCO3)<Ksp(NiCO3):__________________(已知NiCO3为难溶于水的浅绿色固体)。
(4)证明H2SO4的第二步电离不完全:_____________。[查阅资料表明K2(H2SO4)=1.1×10-2]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com