
【题目】某实验小组为了分析补血剂 FeSO4·7H2O 中铁元素的质量分数,用 KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO4- +8H+= 5Fe3++Mn2++4H2O。
(1)实验前,首先要精确配制一定物质的量浓度的 KMnO4 溶液 250 mL,配制时需要用的仪器除天平、药匙、玻璃棒、烧杯、胶头滴管外,还需____________。
(2)滴定前是否要滴加指示剂?_____(填“是”或“否”),理由是_____。
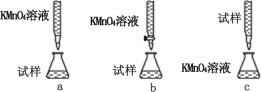
(3)某同学设计的下列滴定方式中,最合理的是_____(填序号)
(4)该实验小组称取 12.0 g 补血剂在容量瓶中配成 100 mL 溶液,量取 25.00 mL 试样溶液, 用 0.100 mol·L-1 KMnO4标准溶液滴定。 达到滴定终点时, 消耗标准溶液20.00 mL,则所测补血剂中铁元素的质量分数是_____(精确至 0.01%)。
(5)若该小组配制溶液和滴定操作时引起的误差忽略,最终所测补血剂中铁元素含量 仍偏小,其可能原因是_____。
【答案】250 mL 容量瓶 否 KMnO4 溶液为紫红色,自身可作指示剂 b 18.67% Fe2+容易被空气中的氧气氧化成 Fe3+,消耗的 KMnO4 溶液体积偏小
【解析】
(1)配制一定物质的量浓度的溶液所需要的仪器有:250mL容量瓶、天平、玻棒、烧杯、量筒、药匙、胶头滴管;
(2)KMnO4 溶液为紫红色,自身可作指示剂,故不需要加指示剂;
(3)高锰酸钾具有强氧化性,能腐蚀碱式滴定管的橡皮管,应用酸式滴定管盛装,滴定时为便于观察颜色变化,滴定终点颜色由浅变深易于观察,应将高锰酸钾滴到待测液中;
(4)根据5Fe2++MnO4- +8H+= 5Fe3++Mn2++4H2O,5Fe2+~MnO4-,则n(Fe)=n(Fe2+)= 5n(MnO4-)=5×0.100 mol·L-1×0.0200 L=0.01mol,m(Fe)=nM=0.01mol×4×56g/mol=2.24g,ω=![]() ×100% =18.67%;
×100% =18.67%;
(5) 最终所测补血剂中铁元素含量仍偏小,可能是由于Fe2+容易被空气中的氧气氧化成 Fe3+,消耗的 KMnO4 溶液体积偏小。


科目:高中化学 来源: 题型:
【题目】科学家分析,地球原始大气中的COS(羰基硫)对氨基酸缩合形成多肽的反应有催化作用,对生命起源起到重要作用。
(1)写出COS的电子式________,C与O形成共价键时,共用电子对会偏向____原子,判断依据是___________。
(2)已知 COS(g)+ H2O(g)![]() H2S(g)+ CO2(g) ΔH1 = - 34kJ/mol
H2S(g)+ CO2(g) ΔH1 = - 34kJ/mol
CO(g)+ H2O(g)![]() H2(g)+ CO2(g) ΔH2 = - 41kJ/mol
H2(g)+ CO2(g) ΔH2 = - 41kJ/mol
写出H2S与CO反应生成 COS 的热化学方程式:_________;100℃ 时将CO与H2S按物质的量比为 1:1 充入反应器中,达平衡后CO的转化率α = 33.3%,此时反应的平衡常数K =______。
(3)在充有催化剂的恒压密闭容器中进行反应。 设起始充入的 n(CO):n(H2S)=m,相同时间内测得H2S转化率与m和温度(T)的关系如图所示。

①m1________m2。(填“ > ”、“ < ”或“ = ”)
②温度高于 T0时,H2S 转化率减小的可能原因为________。
A 反应停止了
B 反应的 ΔH 变大
C 反应达到平衡
D 催化剂活性降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学作为一门基础自然科学,在材料科学、生命科学、能源科学等诸多领域发挥着重要作用,其中铁和铜是两种应用广泛的元素。
(1)基态铁原子的价电子轨道表达式为_____。
(2)磁性材料铁氧体在制备时常加入 CH3COONa、尿素[CO(NH2)2]等碱性物质。尿素分子中所含元素的电负性由小到大的顺序是_____,1mol 尿素分子中含有的 σ 键数目为_____。 CH3COONa 中碳原子的杂化类型为_________。
(3)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则 Fe(CO)5的晶体类型是_____,写出与CO互为等电子体的分子的电子式_____(任写一种)。
(4)CuO在高温时分解为 O2和 Cu2O,请从阳离子的结构来说明在高温时,Cu2O比 CuO更稳定的原因_____。
(5)磷青铜是含少量锡、磷的铜合金,某磷青铜晶胞结构如图所示:
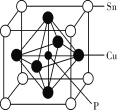
①其化学式为_____。
②若晶体密度为 8.82g/cm3,则最近的 Cu原子核间距为_____pm(用含 NA 的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置能达到实验目的的是( )
A.探究AgCl和AgI之间的转化 
B.比较Cl2、Br2、I2的氧化性强弱 ![]()
C.制备Fe(OH)2 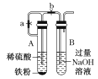
D.用已知浓度的氢氧化钠溶液测定盐酸浓度的实验 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用 R代表)。 回答下列问题:
(1)基态氮原子价层电子的轨道表示式为_____。
(2)氯离子的基态电子排布式为_____,有_____种不同能级的电子。
(3)R 中 H、N、O 三种元素的电负性由大到小的顺序是_____(用元素符号表示)。
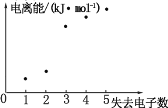
(4)如图表示短周期元素 X 的基态原子失去电子数与对应电离能的关系,试推测 X 与R 中的_____(填元素符号)元素同周期。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊二烯之(![]() ) 是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产,根据能量循环图和表格中的键能,下列说法正确的是
) 是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产,根据能量循环图和表格中的键能,下列说法正确的是
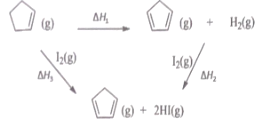
共价键 | 键能/ |
H-H | 436 |
H-I | 299 |
I-I | 151 |
A.△H1+△H2+△H3=0
B.△H1<△H3
C.![]() (g)转化为
(g)转化为![]() (g)的过程中,有C-H的断裂和形成
(g)的过程中,有C-H的断裂和形成
D.在相同条件下,生成 2molHCl(g) 的△H2′<△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亮菌甲素(图 a) 用于急性胆囊炎、慢性胆囊炎发作、其他胆道疾病并发急性感染及慢性浅表性胃炎、萎缩性胃炎, 配以辅料丙二醇溶成针剂用于临床。若使用廉价的二甘醇(图 b) 作为辅料, 会使人中毒。下列说法正确的是
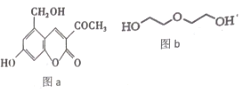
A.l mol 亮菌甲素与溴水混合,最多消耗Br2 4 mol
B.亮菌甲素中所有的碳原子不可能共平面
C.l mol 亮菌甲素反应最多消耗 5molH2或2molNaOH
D.等物质的量的丙二醇和二甘醇充分燃烧消耗的氧气量不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X是某药物的中间体,其结构简式如图所示。下列有关X的说法正确的是( )

A.X的分子式为C27H27O10N
B.与足量H2发生加成反应后,该分子中官能团的种类减少1种
C.一定条件下,X能与乙醇发生酯化反应
D.1mol化合物X最多可与3molNaOH、8molH2发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辣椒的味道主要来自辣椒素类化合物。一种合成辣椒素中间体![]()
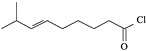
![]() 的合成路线如下:
的合成路线如下:
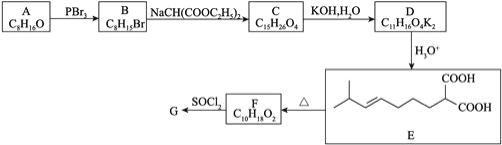
回答下列问题:
![]() 中所含官能团的名称为_____________。
中所含官能团的名称为_____________。
![]() 的结构简式为______________________。
的结构简式为______________________。
![]() 、
、![]() 的反应类型分别是______________、______________。
的反应类型分别是______________、______________。
![]() 的化学方程式为___________________________。
的化学方程式为___________________________。
![]() 满足下列条件的E的同分异构体有________种
满足下列条件的E的同分异构体有________种![]() 不考虑立体异构
不考虑立体异构![]() 。
。
![]() 含有一个六元碳环
含有一个六元碳环![]() 环上三个碳原子分别连有一个取代基且其中两个为羧基。其中核磁共振氢谱有7组峰的结构简式为______________。
环上三个碳原子分别连有一个取代基且其中两个为羧基。其中核磁共振氢谱有7组峰的结构简式为______________。
![]() 参照上述合成路线,以1,
参照上述合成路线,以1,![]() 丁二烯和
丁二烯和![]() 为原料
为原料![]() 无机试剂任选
无机试剂任选![]() ,设计制备
,设计制备 的合成路线_______________。
的合成路线_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com