
【题目】如图为原电池装置示意图:
(1)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为______。
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片 D.铜片、铜片
写出插入烧碱溶液中形成原电池的负极反应式_________。
(2)若A为Pb,B为PbO2,电解质为硫酸溶液,写出B电极反应式:_________;该电池在工作时,A电极的质量将______(填“增重”或“减轻”或“不变”)。若消耗0.1moLH2SO4时,则转移电子数目为______。
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为氢氧燃烧电池,写出A电极反应式:_________;该电池在工作一段时间后,溶液的碱性将______(填“增强”或“减弱”或“不变”)。
(4)若A、B均为铂片,电解质为硫酸溶液,分别从A、B两极通入CH4和O2,该电池即为甲烷燃烧电池,写出A电极反应式:_________;电池工作时阴离子定向移动到______极(填“正”或“负”)。
(5)铁、铜、铝是生活中使用广泛的金属,FeCl3溶液常用于腐蚀印刷电路铜板,其反应过程的离子方程式为_________,若将此反应设计成原电池,则负极所用电极材料为______,正极反应式为_________。
【答案】B Al+4OH--3e-=![]() +2H2O PbO2+
+2H2O PbO2+![]() +4H++2e-=PbSO4+2H2O 增重 0.1NA H2+2OH--2e-=2H2O 减弱 CH4-8e-+2H2O═CO2+8H+ 负 2Fe3++Cu=2Fe2++Cu2+ Cu 2Fe3++2e-=2Fe2+
+4H++2e-=PbSO4+2H2O 增重 0.1NA H2+2OH--2e-=2H2O 减弱 CH4-8e-+2H2O═CO2+8H+ 负 2Fe3++Cu=2Fe2++Cu2+ Cu 2Fe3++2e-=2Fe2+
【解析】
两个活动性不同的电极,用导线连接,与电解质溶液接触,并且至少有一个电极材料能与电解质发生氧化还原反应(燃料电池除外),才可形成原电池。若两个电极材料都能与电解质发生持续的氧化还原反应,则相对活泼的电极为负极,若只有一个电极材料能与电解质发生氧化还原反应,则此电极为负极。
(1)插入浓硝酸中的一组,由于铝片会发生钝化,与浓硝酸的反应不能持续进行,而铜片能与浓硝酸在常温下持续反应,所以铜片为负极;插入烧碱溶液中的一组,只有铝片能与烧碱溶液发生反应,所以铝片为负极,因此,在这两个原电池中,负极分别为铜片、铝片,故选B。插入烧碱溶液中,形成原电池的负极为铝片,失电子产物与OH-发生反应,最终生成![]() 和水,电极反应式为Al+4OH--3e-=
和水,电极反应式为Al+4OH--3e-=![]() +2H2O。答案为:B;Al+4OH--3e-=
+2H2O。答案为:B;Al+4OH--3e-=![]() +2H2O;
+2H2O;
(2)若A为Pb,B为PbO2,电解质为硫酸溶液,则Pb为负极,PbO2为正极,B电极中,PbO2得电子产物与![]() 、H+反应生成PbSO4和H2O,电极反应式为:PbO2+
、H+反应生成PbSO4和H2O,电极反应式为:PbO2+![]() +4H++2e-=PbSO4+2H2O;该电池在工作时,A电极中的Pb失电子产物与
+4H++2e-=PbSO4+2H2O;该电池在工作时,A电极中的Pb失电子产物与![]() 反应生成PbSO4,A极质量将增重;总反应式为Pb+PbO2+2H2SO4=2PbSO4+2H2O,若消耗0.1moLH2SO4时,则转移电子数目为0.1NA。答案为:增重;0.1NA;
反应生成PbSO4,A极质量将增重;总反应式为Pb+PbO2+2H2SO4=2PbSO4+2H2O,若消耗0.1moLH2SO4时,则转移电子数目为0.1NA。答案为:增重;0.1NA;
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为氢氧燃烧电池,A电极为负极,B电极为正极,在A电极,H2失电子产物与OH-反应生成H2O,电极反应式为:H2+2OH--2e-=2H2O;B电极反应式为:O2+4e-+2H2O=4OH-,总反应为:2H2+O2=2H2O,该电池在工作一段时间后,虽然n(OH-)不变,但溶液体积增大,c(OH-)减小,所以溶液的碱性将减弱。答案为:H2+2OH--2e-=2H2O;减弱;
(4)若A、B均为铂片,电解质为硫酸溶液,分别从A、B两极通入CH4和O2,该电池即为甲烷燃料电池,A电极为负极,CH4失电子产物与水反应生成CO2和H+,A电极反应式为:CH4-8e-+2H2O═CO2+8H+;电池工作时阴离子定向移动负极。答案为:CH4-8e-+2H2O═CO2+8H+;负;
(5)FeCl3溶液常用于腐蚀印刷电路铜板时,Fe3+与Cu发生反应生成Fe2+和Cu2+,其反应过程的离子方程式为2Fe3++Cu=2Fe2++Cu2+,若将此反应设计成原电池,负极失电子,则所用电极材料为Cu,正极Fe3+得电子生成Fe2+,电极反应式为2Fe3++2e-=2Fe2+。答案为:2Fe3++Cu=2Fe2++Cu2+;Cu;2Fe3++2e-=2Fe2+。


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】关于下列图象说法正确的是
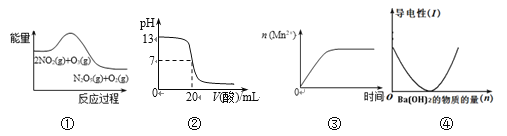
A. ①表示化学反应2NO2(g) + O3(g) = N2O5(g) + O2(g) ΔH > 0
B. ②表示25℃时,用0.1 mol/L CH3COOH溶液滴定20 mL 0.1 mol/L NaOH溶液,溶液的pH随加入酸体积的变化
C. ③表示10 mL 0.01 mol/L酸性KMnO4溶液与过量的0.1 mol/L H2C2O4溶液混合时, n (Mn2+) 随时间的变化
D. ④可表示向稀硫酸溶液中滴加氢氧化钡溶液,溶液导电性随氢氧化钡物质的量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是一种银白色的金属,常用于金属加工、电镀等。工业以铬铁矿[主要成分是Fe(CrO2)2]为原料冶炼铬及获得强氧化剂Na2Cr2O7。其工艺流程如图所示:
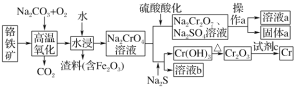
已知:高温氧化时发生反应Fe(CrO2)2+Na2CO3+O2→Na2CrO4+Fe2O3+CO2(未配平)
回答下列问题:
(1)将铬铁矿的主要成分Fe(CrO2)2写成氧化物的形式:__,高温氧化时可以提高反应速率的方法为___(写出一条即可)。
(2)Na2CrO4加入硫酸酸化的离子方程式为__;在实验室中,操作a所用到的玻璃仪器有__。
(3)Na2CrO4中铬元素化合价为__;生成1molNa2CrO4时共转移电子的物质的量为__mol。
(4)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7mol·L-1以下才能排放,可采用加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入硫酸处理多余的Ba2+的方法处理废水,加入可溶性钡盐后,废水中Ba2+的浓度应大于__mol·L-1,废水处理后达到国家标准才能排放。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应4NH3+5O2![]() 4NO+6H2O,下列为4种不同情况下测得的反应速率,表明该反应进行最快的是( )
4NO+6H2O,下列为4种不同情况下测得的反应速率,表明该反应进行最快的是( )
A.v(NH3)=0.2mol/(L·s)B.v(O2)=10mol/(L·min)
C.v(H2O)=0.25mol/(L·s)D.v(NO)=8mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W 有如图所示的转化关系,则 X、W可能的组合有()
![]()
①C、O2②Na、O2③Fe、HNO3④S、O2⑤N2、O2⑥H2S、O2⑦NH3、O2
A.四项B.五项C.六项D.七项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应中,不属于取代反应的是( )
A. ![]() +Cl2
+Cl2![]() +HCl
+HCl
B. CH2=CH2 + Br2 →CH2BrCH2Br
C. ClCH2CH2CH3+NaOH![]() HOCH2CH2CH3+NaCl
HOCH2CH2CH3+NaCl
D. ![]() +HO-NO2
+HO-NO2![]() +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同物质的量的下列有机物,充分燃烧,消耗氧气的量相同的是
A. C3H4和C2H6B. C3H6和C3H8O
C. C3H6O2和C3H8OD. C3H8O和C4H8O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据Cd(Hg)+Hg2SO4=3Hg+Cd2++SO42-反应原理,设计出韦斯顿标准电池,其简易装置如图。下列有关该电池的说法正确的是
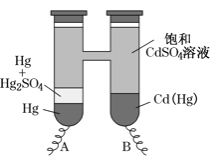
A.电池工作时Cd2+向电极B移动
B.反应中每生成amolHg转移2amol电子
C.电极B上发生的反应:Cd(Hg)-4e-=Hg2++ Cd2+
D.电极A上发生的反应:Hg2SO4+2e-=2Hg+ SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴(Co)与钛(Ti)是均可与强酸发生反应的金属。利用电解原理电解CoCl2溶液制取钴,工作原理如图所示,其中Ti-Ru为惰性电极。下列说法正确的是
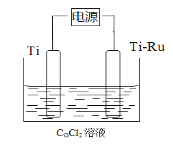
A. 电解时控制CoCl2溶液的pH在0~1范围内
B. 电解过程中Cl在Ti电极放电生成氯气
C. Ti-Ru的作用是作为损耗阳极材料和传递电流
D. 用CoSO4代替CoCl2会使钴的产率降低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com