
【题目】对于反应4NH3+5O2![]() 4NO+6H2O,下列为4种不同情况下测得的反应速率,表明该反应进行最快的是( )
4NO+6H2O,下列为4种不同情况下测得的反应速率,表明该反应进行最快的是( )
A.v(NH3)=0.2mol/(L·s)B.v(O2)=10mol/(L·min)
C.v(H2O)=0.25mol/(L·s)D.v(NO)=8mol/(L·min)
【答案】A
【解析】
由于化学反应速率之比等于化学计量数之比,所以在用不同物质比较化学反应速率的时候,一定要统一单位,并转化为同一种物质进行比较。本题比较时我们选取的单位为mol/(L·min),选取的物质为NH3。
A.v(NH3)=0.2mol/(L·s)=12 mol/(L·min);
B.由v(O2)=10mol/(L·min)且v(NH3):v(O2)=4:5得,v(NH3)= 8mol/(L·min);
C.v(H2O)=0.25mol/(L·s)=15 mol/(L·min),由v(NH3):v(H2O)=2:3得,v(NH3)= 10mol/(L·min);
D.由v(NO)=8mol/(L·min)且v(NH3):v(NO)=1:1得,v(NH3)= 8mol/(L·min);
综上所述,反应进行最快的是A,
故选A。


科目:高中化学 来源: 题型:
【题目】“碘伏”又叫“聚维酮碘溶液”。聚维酮通过氢键与HI3形成聚维酮碘,其结构表示如图所示。下列说法正确的是
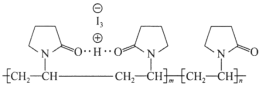 (图中虚线表示氢键)
(图中虚线表示氢键)
A.C、N、O原子的电负性依次增大
B.聚维酮碘中含有离子键、共价键、氢键等化学键
C.聚维酮易溶于水的原因是与水分子间形成氢键
D.分子中的含N五元环一定是平面结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯与液溴制取溴苯:

(1)装置A的名称是_______________。
(2)制取溴苯的化学反应方程式_____________。
(3)反应时,装置B中出现的现象有___________。
(4)冷凝水顺序_______(A.上进下出;B.下进上出),长导管的作用____________,请解释装置C中导管位置为什么不能伸入液面以下____________。
(5)装置D的作用是__________。
(6)反应结束后,将滴液漏斗中的溶液E加入到烧瓶B中,充分振荡后可除去溴苯中的溴,溶液E是_______________;液体经过分液,所得的溴苯中还含有少量苯,如何进行分离________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水电池常用在海上浮标等助航设备中,其示意图如图所示。电池反应为2Li+2H2O=2LiOH+H2↑。电池工作时,下列说法错误的是( )

A.金属锂作负极
B.电子从锂电极经导线流向镍电极
C.海水作为电解质溶液
D.可将电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以淀粉为主要原料合成一种具有果香味的物质C和化合物D的合成路线如下图所示。
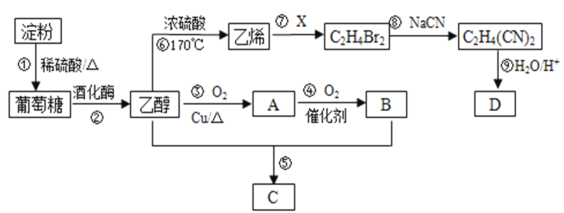
请回答下列问题:
(1)A的结构简式为________,B分子中的官能团名称为________。
(2)反应③的化学方程式为_______。
(3)反应⑤的化学方程式为_________。
(4)已知D的相对分子量为118,有酸性且只含有一种官能团,其中碳、氢两元素的质量分数分别为40.68%、5.08%,其余为氧元素,则D的化学式为______,其结构简式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.56gCu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12L(标准状况),则反应中消耗HNO3的物质的量为
A.0.05molB.0.13molC.1molD.1.05mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为原电池装置示意图:
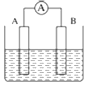
(1)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为______。
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片 D.铜片、铜片
写出插入烧碱溶液中形成原电池的负极反应式_________。
(2)若A为Pb,B为PbO2,电解质为硫酸溶液,写出B电极反应式:_________;该电池在工作时,A电极的质量将______(填“增重”或“减轻”或“不变”)。若消耗0.1moLH2SO4时,则转移电子数目为______。
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为氢氧燃烧电池,写出A电极反应式:_________;该电池在工作一段时间后,溶液的碱性将______(填“增强”或“减弱”或“不变”)。
(4)若A、B均为铂片,电解质为硫酸溶液,分别从A、B两极通入CH4和O2,该电池即为甲烷燃烧电池,写出A电极反应式:_________;电池工作时阴离子定向移动到______极(填“正”或“负”)。
(5)铁、铜、铝是生活中使用广泛的金属,FeCl3溶液常用于腐蚀印刷电路铜板,其反应过程的离子方程式为_________,若将此反应设计成原电池,则负极所用电极材料为______,正极反应式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋资源的利用具有广阔前景。
(1)下图是从海水中提取镁的简单流程。

①工业上常用于沉淀Mg2+的试剂A是_____________。
②由无水MgCl2制取Mg的化学方程式是_______________。
(2)海带灰中富含以I-形式存在的碘元素.实验室提取I2的途径如下所示:
干海带![]() 海带灰
海带灰![]() 滤液
滤液![]()
![]() I2
I2
①灼烧海带至灰烬时所用的主要仪器名称是___________ 。
②向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式______________。
③反应结束后,加入CCl4作萃取剂,采用萃取—分液的方法从碘水中提取碘,主要操作步骤如图:

甲、乙、丙3步实验操作中,不正确的是_________ (填“甲”、“乙”或“丙”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在恒容密闭容器中充入一定量的N2O5,发生反应: 2N2O5(g)![]() 4NO2(g)+O2(g),能判断反应已经达到平衡状态的是
4NO2(g)+O2(g),能判断反应已经达到平衡状态的是
A. NO2和O2的浓度比保持不变B. 容器中的压强不再变化
C. 2υ正(NO2)=υ逆(N2O5)D. 气体的平均相对分子质量为43.2,且保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com