
【题目】如图是人类从海水资源获取某些重要化工原料的流程示意图: 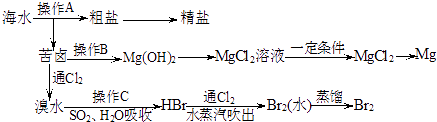
回答下列问题:
(1)操作A是和过滤(填实验基本操作名称).
(2)操作B需加入下列试剂中的一种,最合适的是(选填编号).
a.氢氧化钠溶液 b.澄清石灰水 c.石灰乳 d.碳酸钠溶液
(3)向苦卤中通入Cl2 , 发生反应的离子方程式是 , 用SO2水溶液吸收Br2 , 吸收率可达95%,有关反应的离子方程式为 .
(4)工业上由无水MgCl2制取镁的化学方程式为 .
【答案】
(1)蒸发结晶
(2)c
(3)Cl2+2Br﹣=Br2+2Cl﹣;Br2+SO2+2H2O=4H++SO42﹣+2Br﹣
(4)MgCl2(熔融) ![]() ?Mg+Cl2↑
?Mg+Cl2↑
【解析】解:(1)食盐的溶解度受温度变化影响较小,可以通过蒸发结晶的方法得到氯化钠,所以答案是:蒸发结晶;(2)工业制镁:把海边的贝壳制成生石灰:CaCO3 ![]() CaO+CO2↑,在海水中加入生石灰:CaO+H2O═Ca(OH)2 , 在引入的海水中加入石灰乳,发生反应:MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2 , 这样原料的成本低,且能将镁离子全部沉淀下来,所以最合适的是石灰乳,故选:c;(3)氯气氧化溴离子得到单质溴,离子方程式为:Cl2+2Br﹣=Br2+2Cl﹣ , 溴具有强氧化性,二氧化硫具有还原性,二者能发生氧化还原生成硫酸和氢溴酸,离子反应方程式为:Br2+SO2+2H2O=4H++SO42﹣+2Br﹣ , 所以答案是:Cl2+2Br﹣=Br2+2Cl﹣;Br2+SO2+2H2O=4H++SO42﹣+2Br﹣;(4)电解无水MgCl2可得金属镁和氯气,其反应的化学方程式为:MgCl2(熔融)
CaO+CO2↑,在海水中加入生石灰:CaO+H2O═Ca(OH)2 , 在引入的海水中加入石灰乳,发生反应:MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2 , 这样原料的成本低,且能将镁离子全部沉淀下来,所以最合适的是石灰乳,故选:c;(3)氯气氧化溴离子得到单质溴,离子方程式为:Cl2+2Br﹣=Br2+2Cl﹣ , 溴具有强氧化性,二氧化硫具有还原性,二者能发生氧化还原生成硫酸和氢溴酸,离子反应方程式为:Br2+SO2+2H2O=4H++SO42﹣+2Br﹣ , 所以答案是:Cl2+2Br﹣=Br2+2Cl﹣;Br2+SO2+2H2O=4H++SO42﹣+2Br﹣;(4)电解无水MgCl2可得金属镁和氯气,其反应的化学方程式为:MgCl2(熔融) ![]() Mg+Cl2↑,所以答案是:MgCl2(熔融)
Mg+Cl2↑,所以答案是:MgCl2(熔融) ![]() Mg+Cl2↑.
Mg+Cl2↑.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】在一个不传热的固定容积的密闭容器中发生可逆反应:mA(g)+nB(g)![]() pC(g)+ qQ(g),当m、n、p、q为任意整数时,达到平衡状态的标志是
pC(g)+ qQ(g),当m、n、p、q为任意整数时,达到平衡状态的标志是
①体系的压强不再改变
②体系的温度不再改变
③各组分的浓度不再改变
④各组分的质量分数不再改变
⑤反应速率v(A):v(B):v(C):v(D)=m:n:p:q
⑥单位时间内m mol A断键反应,同时p mol C也断键反应
A.③④⑤⑥B.②③④⑥
C.①③④⑤D.①③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构为下图所示,这种有机物不可能具有的性质是( )
①可以燃烧;②能使酸性KMnO4溶液褪色;
③能跟NaOH溶液反应; ④能发生酯化反应;
⑤能发生加聚反应;⑥能发生水解反应.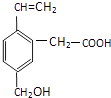
A.①④
B.只有⑥
C.只有⑤
D.④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关环境保护的说法中,正确的是( )
A.锌锰干电池用后可以随意丢弃
B.化石燃料完全燃烧不会造成大气污染
C.将煤脱硫后再燃烧可减少大气污染
D.“低碳”生活倡导节能减排,应禁止使用化石燃料,减少污水排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。可以判断该分解反应已经达到化学平衡的是
2NH3(g)+CO2(g)。可以判断该分解反应已经达到化学平衡的是
A.密闭容器中二氧化碳的体积分数不变
B.密闭容器中气体的总物质的量改变
C.密闭容器中混合气体的密度不变
D.2v正(NH3)=v逆(CO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应CO(g)+2H2(g)![]() CH3OH(g)ΔH=Q kJ·mol1;在三个不同容积的容器中分别充入1 mol CO与2 mol H2,恒温恒容,测得平衡时CO的转化率如下表。下列说法正确的是
CH3OH(g)ΔH=Q kJ·mol1;在三个不同容积的容器中分别充入1 mol CO与2 mol H2,恒温恒容,测得平衡时CO的转化率如下表。下列说法正确的是
温度(℃) | 容器体积 | CO转化率 | 平衡压强(p) | |
① | 200 | V1 | 50% | p1 |
② | 200 | V2 | 70% | p2 |
③ | 350 | V3 | 50% | p3 |
A.反应速率:③>①>②
B.平衡时体系压强:p1∶p2=5∶4
C.若容器体积V1>V3,则Q<0
D.若实验②中CO和H2用量均加倍,则CO转化率<70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物(CH3)2CClCH3与CH3CH2CH2CH2Cl的关系为( )
A.官能团异构体B.碳链异构体
C.(官能团)位置异构体D.顺反异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置.
如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:
(1)氢氧燃料电池的能量转化的主要形式是由 , 在导线中电子流动方向为(用a、b表示).
(2)负极反应式为 .
(3)电极表面镀铂粉的原因是 .
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能.因此,大量安全储氢是关键技术之一.金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ2Li+H2 ![]() 2LiH
2LiH
ⅡLiH+H2O═LiOH+H2↑
①反应Ⅰ中的还原剂是 , 反应Ⅱ中的氧化剂是 . (均填化学式)
②已知LiH固体密度为0.82g/cm3 , 用锂吸收224L(标准状况)H2 , 则被吸收的H2体积与生成的LiH体积比为 .
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为mol.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com