
【题目】在一个不传热的固定容积的密闭容器中发生可逆反应:mA(g)+nB(g)![]() pC(g)+ qQ(g),当m、n、p、q为任意整数时,达到平衡状态的标志是
pC(g)+ qQ(g),当m、n、p、q为任意整数时,达到平衡状态的标志是
①体系的压强不再改变
②体系的温度不再改变
③各组分的浓度不再改变
④各组分的质量分数不再改变
⑤反应速率v(A):v(B):v(C):v(D)=m:n:p:q
⑥单位时间内m mol A断键反应,同时p mol C也断键反应
A.③④⑤⑥B.②③④⑥
C.①③④⑤D.①③④⑥
【答案】B
【解析】①如果该反应是一个反应前后气体体积不变的可逆反应,则体系的压强始终不变,所以不能根据压强判断反应是否达到平衡状态,错误;②任何化学反应均有能量变化,在一个不传热的固定容积的密闭容器中进行的可逆反应,体系的温度不再改变,说明反应达到平衡状态,正确;③各组分的物质的量浓度不再改变,该反应达到平衡状态,正确;④当该反应达到平衡状态,各组分的质量分数不再改变,正确;⑤反应速率v(A):v(B):v(C):v(D)=m:n:p:q,等式恒成立,不能据此判断该反应是否达到平衡状态,错误;⑥单位时间内m mol A断键反应,同时p mol C也断键反应,说明v(正)=v(逆),能够判断该反应达到了平衡状态,正确;②③④⑥正确,答案选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】【2017宁波模拟】某温度下,在2L密闭容器中投入一定量的A、B发生反应:3A(g)+bB (g)cC(g)△H=﹣Q kJmol﹣1(Q>0).12s 时达到平衡,生成C的物质的量为0.8mol,反应过程如图所示.下列说法正确的是( )

A.前12s内,A的平均反应速率为0.025molL﹣1s﹣1
B.12s后,A的消耗速率等于B的生成速率
C.化学计量数之比b:c=1:2
D.12s内,A和B反应放出的热量为0.2Q kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中有一未知浓度的稀盐酸,某同学在实验室中进行实验测定盐酸的浓度。请完成下列填空:
(1)配制100mL0.10molL-1 NaOH标准溶液。
① 主要操作步骤:计算→称量→溶解→_______(冷却后)→洗涤(并将洗涤液移入容量瓶)→定容→摇匀→将配制好的溶液倒入试剂瓶中,贴上标签。
② 称量_____g氢氧化钠固体所需仪器有:天平(带砝码、镊子)、________、烧杯(或表面皿)。
(2)取20.00 mL待测盐酸放入锥形瓶中,并滴加23滴酚酞作指示剂,用配制的标准NaOH溶液进行滴定。重复上述滴定操作23次,记录数据如下:
实验编号 | NaOH溶液的浓度(molL-1) | 滴入NaOH溶液的体积(mL) | 待测盐酸的体积(mL) |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
①碱式滴定管用蒸馏水洗净后,接下来应该进行的操作是________________________________。
②下列试剂①HF溶液 ②KMnO4溶液 ③乙醇 ④CH3COONa溶液,其中_____________(填序号)
不能用酸式滴定管来盛装
③该实验滴定达到终点的标志是_______________________________。
④根据上述数据,可计算出该盐酸的浓度约为_________________(保留两位有效数字)
⑤接近滴定终点时由于滴速过快,如何确定标准液是否滴加过量?_______________________
⑥在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______________________
A.滴定终点读数时俯视读数 B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥 D.碱式滴定管尖嘴部分有气泡,滴定后消失
E.称量NaOH固体时,混入少量KOH杂质
⑦现用以上实验配制的0.10 molL-1NaOH溶液测定食醋中乙酸的浓度,应该选用的试剂为__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关肥皂的叙述中正确的有( )
①利用油脂在碱性条件下进行水解而制得 ②普通肥皂的主要成分是高级脂肪酸钠和甘油 ③使肥皂从油脂水解后的混合物中分离的过程是盐析 ④肥皂制成后再不能溶于水形成胶体溶液
A. ①② B. ②④ C. ③④ D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电影《闪闪的红星》中,为让被困的红军战士吃上食盐,潘冬子将浸透食盐水的棉袄裹在身上,带进山中。假如潘冬子在实验室中,欲从食盐水中提取出食盐,采用的最好方法是( )
A. 过滤 B. 萃取 C. 蒸发 D. 蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于合成氨反应:N2+3H2 ![]() 2NH3 , △H<0;达到平衡后,以下分析正确的是( )
2NH3 , △H<0;达到平衡后,以下分析正确的是( )
A.升高温度,对正反应的反应速率影响更大
B.增大压强,对正反应的反应速率影响更大
C.减小反应物浓度,对逆反应的反应速率影响更大
D.加入催化剂,同等程度地改变正、逆反反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将甲酸(HCOOH)和氢氧化钠溶液混合,所得溶液 pH=7,则此溶液中
A. c(HCOO-) >c(Na+)B. c(HCOO-) <c( Na+)
C. c(HCOO-) =c(Na+)D. 无法确定c(HCOO-) 与c(Na+) 的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应C(s)+H2O(g)![]() CO(g)+H2(g) ΔH>0,向甲、乙、丙三个恒容容器中加入一定量C 和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法正确的是
CO(g)+H2(g) ΔH>0,向甲、乙、丙三个恒容容器中加入一定量C 和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法正确的是
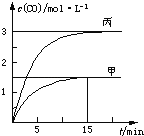
容器 | 甲 | 乙 | 丙 |
容积 | 0.5 L | 0.5 L | V |
温度 | T1℃ | T2℃ | T1℃ |
起始量 | 2 mol C 1 mol H2O | 1 mol CO 1 mol H2 | 4 mol C 2 mol H2O |
A.甲容器中,反应在前15 min的平均速率v(H2)=0.1 mol·L1·min1
B.丙容器的体积V<0.5 L
C.当温度为T1℃时,反应的平衡常数K=2.25
D.乙容器中,若平衡时n(H2O)=0.4 mol,则T1<T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是人类从海水资源获取某些重要化工原料的流程示意图: 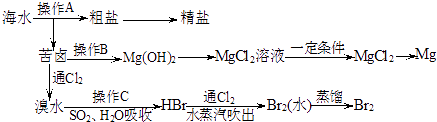
回答下列问题:
(1)操作A是和过滤(填实验基本操作名称).
(2)操作B需加入下列试剂中的一种,最合适的是(选填编号).
a.氢氧化钠溶液 b.澄清石灰水 c.石灰乳 d.碳酸钠溶液
(3)向苦卤中通入Cl2 , 发生反应的离子方程式是 , 用SO2水溶液吸收Br2 , 吸收率可达95%,有关反应的离子方程式为 .
(4)工业上由无水MgCl2制取镁的化学方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com