
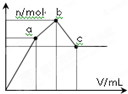
 向100mL 0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )
向100mL 0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )| A、a点的溶液呈中性 |
| B、b点发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH-═Al(OH)3↓+2BaSO4↓ |
| C、c点加入Ba(OH)2溶液的体积为200mL |
| D、c点溶液呈碱性 |
| 0.025mol |
| 0.1mol/L |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、锌是负极、铜是正极 |
| B、电子从铜片经导线流向锌片 |
| C、负极的反应式为2H++2e-═H2↑ |
| D、反应一段时间后,溶液的pH升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属比非金属易失电子,所以金属可以置换非金属,而非金属不能置换金属 |
| B、不含金属元素的化合物也可能是离子化合物 |
| C、变价金属一定是过渡元素 |
| D、显酸性的溶液中溶质只能是酸或强酸弱碱盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 向20mL AlCl3溶液中滴入2mol?L-1 NaOH溶液时,沉淀质量与所滴加NaOH溶液体积(mL)关系如图所示:
向20mL AlCl3溶液中滴入2mol?L-1 NaOH溶液时,沉淀质量与所滴加NaOH溶液体积(mL)关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
 把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58 g白色沉淀生成,在所得的浑浊液中,逐滴加入0.5mol/L盐酸,加入盐酸的体积(V)与生成沉淀的质量(W)关系如图所示:
把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58 g白色沉淀生成,在所得的浑浊液中,逐滴加入0.5mol/L盐酸,加入盐酸的体积(V)与生成沉淀的质量(W)关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com