
| ||
| ||
| ||
| ||


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
| A、苯与浓硝酸在浓硫酸作用下共热至50~60℃ |
| B、乙烯通入溴水中 |
| C、苯与氢气在催化剂作用下反应制得环己烷 |
| D、苯与溴水混合后,溴水层褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、6.02×1023这个常数 |
| B、0.012kg的碳 |
| C、1摩尔任何物质所含的微粒数 |
| D、0.012kg的12C所含有的原子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、9:4:1 |
| B、10:4:1 |
| C、5:4:1 |
| D、3:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
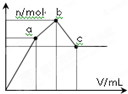 向100mL 0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )
向100mL 0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )| A、a点的溶液呈中性 |
| B、b点发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH-═Al(OH)3↓+2BaSO4↓ |
| C、c点加入Ba(OH)2溶液的体积为200mL |
| D、c点溶液呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④⑤③⑥ |
| B、①⑤③④⑥② |
| C、①④②⑥③⑤ |
| D、①④②③⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com