
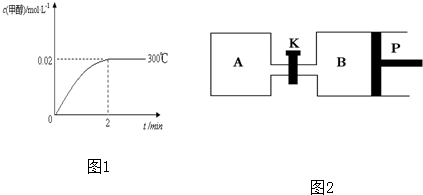
| △c(H2) |
| △t |
| 0.04mol/L |
| 2min |
| c(CH3OH) |
| c(CO)c2(H2) |
| 0.02mol/L |
| 0.08mol/L×(0.25mol/L)2 |
| c(CH3OH) |
| c(CO)c2(H2) |
| 0.50 |
| 0.25×0.502 |
 ,
, ;
;| 0.9mol |
| 1.2mol |


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
| A、Q1>Q2 |
| B、Q1=Q2 |
| C、Q1<Q2 |
| D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 向20mL AlCl3溶液中滴入2mol?L-1 NaOH溶液时,沉淀质量与所滴加NaOH溶液体积(mL)关系如图所示:
向20mL AlCl3溶液中滴入2mol?L-1 NaOH溶液时,沉淀质量与所滴加NaOH溶液体积(mL)关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
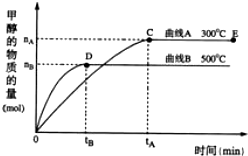
查看答案和解析>>
科目:高中化学 来源: 题型:
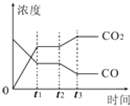 Ⅰ、对于反应CO(g)+H2O(g)?H2(g)+CO2(g)
Ⅰ、对于反应CO(g)+H2O(g)?H2(g)+CO2(g)| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
| 实验编号 | n(CO) | n(H2O) | n(H2) | n(CO2) |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 0.5 | 2 | 1 | 1 |
2- 7 |
2- 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| H2O(g) | H2S (g) | ZnO(s) | ZnS(s) | |
| △H1/kJ/mol | -242 | -20 | -348 | -189 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Te元素位于周期表中第六周期第ⅥA族 |
| B、H2TeO4的酸性比H2SO4弱 |
| C、H2Te没有HI稳定 |
| D、单质碲在常温下是固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com