
| A、Te元素位于周期表中第六周期第ⅥA族 |
| B、H2TeO4的酸性比H2SO4弱 |
| C、H2Te没有HI稳定 |
| D、单质碲在常温下是固体 |


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
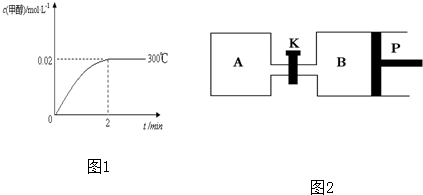
查看答案和解析>>
科目:高中化学 来源: 题型:
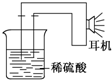 利用生活中或实验室中常用的物品,根据氧化还原反应知识和电学知识,自己动手设计一个原电池.请填写下列空白:
利用生活中或实验室中常用的物品,根据氧化还原反应知识和电学知识,自己动手设计一个原电池.请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④⑤③⑥ |
| B、①⑤③④⑥② |
| C、①④②⑥③⑤ |
| D、①④②③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
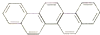 举世瞩目的2012年奥运会在伦敦召开,有一种有机物,因其酷似奥林匹克旗中的五环.科学家称其为奥林匹克烃,下列有关奥林匹克烃的说法正确的是( )
举世瞩目的2012年奥运会在伦敦召开,有一种有机物,因其酷似奥林匹克旗中的五环.科学家称其为奥林匹克烃,下列有关奥林匹克烃的说法正确的是( )| A、该烃的一氯代物只有六种 |
| B、该烃分子中只含非极性键 |
| C、该烃完全燃烧生成H2O的物质的量小于CO2的物质的量 |
| D、该烃属于苯的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、XYZ3是一种含氧酸,且X与Y可形成共价化合物XY |
| B、XYZ3是一种含氧酸,且Y与Z可形成共价化合物YZ2 |
| C、XYZ3是一种微溶于水的盐,且X与Z可形成离子化合物XZ |
| D、XYZ3是一种易溶于水的盐,且Y与Z可形成共价化合物YZ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 2 |
| 3 |
A、
| ||
| B、0.73mol | ||
| C、1mol | ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
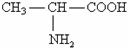 ,则下列说法不正确的是( )
,则下列说法不正确的是( )A、丙氨酸与氢氧化钠溶液反应生成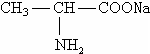 |
B、丙氨酸与盐酸反应生成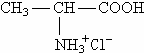 |
C、丙氨酸分子间发生成肽反应生成二肽的结构为 |
| D、丙氨酸不属于a-氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.3 mol?(L?min)-1 |
| B、0.6mol?(L?min)-1 |
| C、0.2 mol?(L?min)-1 |
| D、0.1 mol?(L?min)-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com