
| A、9:4:1 |
| B、10:4:1 |
| C、5:4:1 |
| D、3:1:1 |
| ||
| ||
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| ||
| ||
| 36.5×n1 |
| 36.5n1+18n2 |
| n1 |
| n2 |
| 1 |
| 4 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、蛋白质溶液中加入饱和硫酸铵溶液,蛋白质析出,如再加水也不溶解 |
| B、蛋白质中的蛋白质分子能透过滤纸,但不能透过半透膜 |
| C、重金属盐使蛋白质变性,所以吞服“钡餐”会引起中毒 |
| D、浓硝酸溅在皮肤上,能使皮肤呈黄色是因为蛋白质和浓硝酸发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2与H2在一定条件下反应生成NH3 |
| B、由NH3制碳铵和硫铵等化肥 |
| C、NH3经催化氧化生成NO |
| D、NO与O2反应生成NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 向20mL AlCl3溶液中滴入2mol?L-1 NaOH溶液时,沉淀质量与所滴加NaOH溶液体积(mL)关系如图所示:
向20mL AlCl3溶液中滴入2mol?L-1 NaOH溶液时,沉淀质量与所滴加NaOH溶液体积(mL)关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.2mol/L |
| B、2 mol/L |
| C、0.2 mol/L |
| D、0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
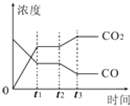 Ⅰ、对于反应CO(g)+H2O(g)?H2(g)+CO2(g)
Ⅰ、对于反应CO(g)+H2O(g)?H2(g)+CO2(g)| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
| 实验编号 | n(CO) | n(H2O) | n(H2) | n(CO2) |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 0.5 | 2 | 1 | 1 |
2- 7 |
2- 7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com