
【题目】气体A、B分别为0.6 mol和0.5 mol,在0.4 L密闭容器中发生反应:3A+B![]() aC+2D,经5 min后,此时C为0.2 mol,又知在此反应时间内,D的平均反应速率为0.1 mol·(L·min)-1,下列结论正确的是( )
aC+2D,经5 min后,此时C为0.2 mol,又知在此反应时间内,D的平均反应速率为0.1 mol·(L·min)-1,下列结论正确的是( )
A. 此时,反应混合物总的物质的量为1 mol B. B的转化率为50%
C. A的平均反应速率为0.1 mol·L-1·min-1 D. a值为2
【答案】D
【解析】试题分析:D的平衡反应速率为0.1mol·L-1·min-1,则在平衡时生成D的物质的量为:
0.1mol·L-1·min-1×0.4L×5min=0.2mol;由于在平衡时,生成C、D的物质的量均为0.2mol,故a的值应为2;依据反应方程式,生成0.2mol D,需消耗×0.2mol=0.1mol的B,故B的转化率为0.1/0.5="20%"
生成0.2mol D,需消耗A为0.3mol,故A的反应速率为:0.3/0.4*5 =0.15mol/Lmin;平衡时混合气体的总物质的量为:(0.6mol-0.3mol)+(0.5mol-0.1mol)+0.2mol+0.2 mol=1.1mol。故答案选D


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)选择下列实验方法分离物质,将分离方法的序号填在横线上。
A.萃取分液 B.升华 C.结晶 D.分液 E.蒸馏 F.过滤
①______分离饱和食盐水与沙子的混合物。
②______分离稀硫酸和汽油的混合物。
③______从溴水中提取溴。
(2)在标准状况下,下列物质:
①4 g H2,②33.6 L CH4,③1.6 mol H2O,其中所含分子数最多的是__________(填序号,下同);体积最小的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究外界条件对反应:mA(g)+nB(g)![]() cZ(g) △H的影响,以A和B物质的量之比为m∶n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如下图所示。下列判断正确的是
cZ(g) △H的影响,以A和B物质的量之比为m∶n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如下图所示。下列判断正确的是
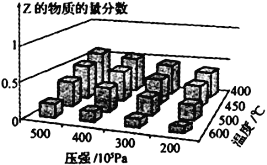
A. 在恒温恒压条件下,向已达到平衡的体系中加入少量Z,达新平衡时,Z的物质的量分数增大
B. 升高温度,正、逆反应速率都增大,平衡常数增大
C. 温度不变,减小压强,平衡逆向移动,达新平衡时,A的浓度比原平衡减小
D. △H>0,m+n>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯二氢硅(SiH2C12)常作于外延法工艺中重要的硅源。易燃、有毒,与水接触易水解,沸点8.2℃。在铜催化作用下,HCl 与硅在250-260℃反应可以制得SiH2Cl2.
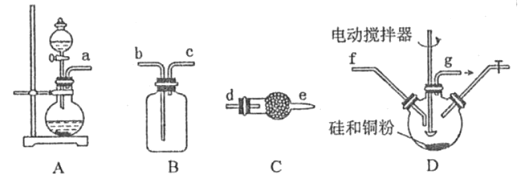
(1) 利用浓硫酸、浓盐酸为原料,选用A 装置制取HC1,利用了浓硫酸的_______性。
(2)D 装置中生成 二氯二氢硅的化学方程式为___________________。
(3) 按照气体从左到右方向,制取SiH2Cl2的装置连接次序为a→___→___→f→g→___→___→____→_____(填仪器接口的字母,其中装置C 用到2 次).其中装置B 的作用是____;前面装置C 中装的药品为______,后面装置C的作用为____________。
(4)新的制取SiH2Cl2 方法是: 往硅粉中先通入Cl2在300-350℃反应生成SiCl4,然后再与HCl 在250-260℃反应,可以大大提高产率。如果通入气体次序相反,产率会降低,其原因是__________(用化学方程式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丁基甲酸是重要的有机合成中间体,其一种合成路线如下:

回答以下问题:
(1)A属于烯烃,其结构简式为____________________。
(2)B→C的反应类型是_________________,该反应生成的与C互为同分异构体的副产物是__________________(写结构简式)。
(3)E的化学名称是___________________________。
(4)写出D生成E的化学方程式_______________________________________________。
(5)H的一种同分异构体为丙烯酸乙酯(CH2=CH—COOC2H5),写出聚丙烯酸乙酯在NaOH溶液中水解的化学方程式_________________________________________________________。
(6)写出同时满足下列条件的G的所有同分异构体__________________________________。
(写结构简式,不考虑立体异构)。
①核磁共振氢谱为3组峰; ②能使溴的四氯化碳溶液褪色;
③1mol该同分异构体与足量饱和NaHCO3反应产生88g气体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方法可行的是
A. 将乙醇和浓H2SO4混合液水浴加热制取乙烯 B. 用溴水除去苯中的苯酚
C. 用CCl4萃取溶解在溴苯中的溴单质 D. 用溴水除去乙烷中的乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L的密闭容器中,某化学反应2A![]() B+D在四种不同条件下进行,A、B、D都为气体,且B、D起始浓度为0,反应物A的物质的量(mol)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,A、B、D都为气体,且B、D起始浓度为0,反应物A的物质的量(mol)随反应时间(min)的变化情况如下表:

根据上述数据,回答以下问题:
(1)实验1中,10至30分钟时间内A的平均反应速率为________mol·L-1·min-1,达平衡时B物质的浓度为________,A的转化率为________。
(2)实验2中,隐含的反应条件可能是________。
(3)实验3中,A的起始的物质的量________(填“>”“<”或“=”)1.0 mol,实验3和实验1的起始速率v3________(填“>”“<”或“=”)v1,由实验1和实验5可确定上述反应为________(填“放热”或“吸热”) 反应,实验4中,该反应温度下其平衡常数为________。
(4)若开始时在实验2的密闭容器中充入1.0molB,1.0molD,达平衡时A物质的浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛(Ti)被誉为21世纪金属,其单质和化合物具有广泛的应用价值。
请回答下列问题:
(1)Ti的基态原子价电子排布式为______。
(2)纳米TiO2常用作下述反应的催化剂。

化合物甲的分子中采取sp2方式杂化的碳原子有_____________个,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺序为___________________。
(3)含Ti3+的配合物的化学式为[TiCl(H2O)5]Cl2·H2O,其配离子中含有的化学键类型是____________,1 mol该配合物中含有的![]() 键数目是____________。
键数目是____________。
(4)通过X—射线探知KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似。且知三种 离子晶体的晶格能数据如下:

KCl、MgO、CaO、TiN四种离子晶体熔点由高到低的顺序为______________________。
(5)某种氮化钛晶体的晶胞如图所示,该晶体中与N原子距离相等且最近的N原子有_____个:Ti原子的配位数为______;此配位原子构成的空间构型为_____;该晶胞中N、Ti原子之间的最近距离为a nm。则该氮化钛晶体的密度为______g·cm-3、NA为阿伏加德罗常数的值,只列计算式)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com