
【题目】已知室温时,![]() 某一元酸HA在水中有
某一元酸HA在水中有![]() 发生电离,下列叙述不正确的是
发生电离,下列叙述不正确的是![]()
①该溶液的![]() ;
;
②升高温度,溶液的pH增大;
③此酸的电离平衡常数约为![]() ;
;
④加水稀释后,各离子的浓度均减小;
⑤由HA电离出的![]() 约为水电离出的
约为水电离出的![]() 的
的![]() 倍;
倍;
⑥适当增大HA的浓度,HA的电离平衡正向移动,电离平衡常数增大。
A.②④⑥B.①④⑤C.②⑤⑥D.②④⑤
【答案】A
【解析】
室温时,![]() 某一元酸HA在水中有
某一元酸HA在水中有![]() 发生电离,该溶液中
发生电离,该溶液中![]() ,
,
![]() 该溶液的
该溶液的![]() ;
;
![]() 升高温度,促进HA电离;
升高温度,促进HA电离;
![]() 此酸的电离平衡常数
此酸的电离平衡常数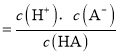 ;
;
![]() 加水稀释后,溶液中
加水稀释后,溶液中![]() 增大;
增大;
![]() 该溶液中水电离出的
该溶液中水电离出的![]() ;
;
![]() 电离平衡常数只与温度有关,温度不变,电离平衡常数不变。
电离平衡常数只与温度有关,温度不变,电离平衡常数不变。
室温时,![]() 某一元酸HA在水中有
某一元酸HA在水中有![]() 发生电离,该溶液中
发生电离,该溶液中![]() ,
,
![]() 该溶液的
该溶液的![]() ,故正确;
,故正确;
![]() 升高温度,促进HA电离,则溶液中
升高温度,促进HA电离,则溶液中![]() 增大,溶液在pH减小,故错误;
增大,溶液在pH减小,故错误;
![]() 此酸的电离平衡常数
此酸的电离平衡常数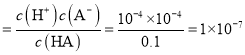 ,故正确;
,故正确;
![]() 加水稀释后,促进HA电离,HA电离增大程度小于溶液体积增大程度,则溶液中
加水稀释后,促进HA电离,HA电离增大程度小于溶液体积增大程度,则溶液中![]() 减小,温度不变水的离子积常数不变,则溶液中
减小,温度不变水的离子积常数不变,则溶液中![]() 增大,故错误;
增大,故错误;
![]() 该溶液中水电离出的
该溶液中水电离出的![]() ,溶液中
,溶液中![]() ,所以由HA电离出的
,所以由HA电离出的![]() 约为水电离出的
约为水电离出的![]() 的
的![]() 倍,故正确;
倍,故正确;
![]() 电离平衡常数只与温度有关,温度不变,电离平衡常数不变,故错误;
电离平衡常数只与温度有关,温度不变,电离平衡常数不变,故错误;
故选A。


科目:高中化学 来源: 题型:
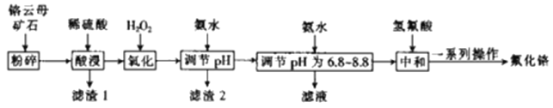
【题目】氟化铬可用作毛织品防蛀剂、卤化催化剂、大理石硬化及着色剂。以铬云母矿石(含4.5%Cr2O3,还含Fe2O3、FeO、MgO、SiO2)为原料制备氟化铬的工艺流程如下。
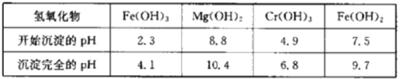
下表列出了相关金属离子生成氢氧化物沉淀的pH:
请回答下列问题:
(1)Fe2O3、MgO、FeO、SiO2中属于碱性氧化物的有___种。
(2)将铬云母矿石粉碎的目的是___。
(3)滤渣1主要成分的用途是___。(写一种)
(4)Cr2O3与稀硫酸反应的化学方程式为___。
(5)第一次滴加氨水调节pH范围为___。
(6)第二次滴加氨水调节pH为6.8~8.8的目的是___,Cr(OH)3与Al(OH)3一样具有两性,若第二次滴加的氨水改为NaOH溶液,生成的Cr(OH)3会部分溶解,写出Cr(OH)3溶解的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温时,向![]() 溶液中滴加
溶液中滴加![]() 溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示
溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示![]() 无气体溢出
无气体溢出![]() ,以下说法不正确的是
,以下说法不正确的是![]()
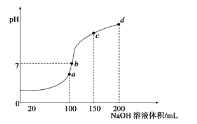
A.a点时水的电离程度最大
B.b点时溶液中的离子浓度关系有![]()
C.c点时溶液中的粒子浓度大小关系为![]()
D.d点时溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不能用勒夏特列原理解释的是
A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率
B.H2(g)+I2(g)![]() 2HI(g)的平衡体系中压缩容器体积后颜色变深
2HI(g)的平衡体系中压缩容器体积后颜色变深
C.Na2CrO4溶液中滴加稀硫酸,溶液颜色变深
D.实验室用排饱和食盐水的方法收集氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将NaOH溶液分别加到HA、HB两种弱酸溶液中,两溶液中pH与粒子浓度比值的对数关系如图所示,已知![]() ,下列有关叙述错误的是( )
,下列有关叙述错误的是( )

A.HA、HB两种酸中,HB的酸性弱于HA
B.b点时,![]()
C.同浓度同体积的NaA和NaB溶液中,阴离子总数相等
D.向HB溶液中加入NaOH溶液所得的混合溶液中,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)CoCl2溶液能发生如下变化:
CoCl2![]() Co(OH)2
Co(OH)2![]() [Co(NH3)6]2+
[Co(NH3)6]2+![]() X
X![]() 晶体Y(CoCl3·5NH3)
晶体Y(CoCl3·5NH3)
向X溶液中加入强碱并加热至沸腾有氨气放出,同时产生Co2O3沉淀;若向Y的溶液中加AgNO3溶液,有AgCl沉淀生成,滤出沉淀,再向滤液中加入AgNO3溶液无变化,但加热至沸腾时又有AgCl沉淀生成,其沉淀量为上次沉淀量的一半。请回答下列问题:
(1)反应②的离子方程式是__________________________________________。
(2)反应①~③中属于氧化还原反应的是______,配合物Y的化学式为______。
(Ⅱ)一定条件下,将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,发生反应CH4(g)+H2O(g) ![]() CO(g)+3H2(g),达到平衡时测得CO的物质的量为0.10mol。若平衡常数K=27,试计算(要求写出计算过程,计算结果保留两位有效数字):
CO(g)+3H2(g),达到平衡时测得CO的物质的量为0.10mol。若平衡常数K=27,试计算(要求写出计算过程,计算结果保留两位有效数字):
(1)初始加入容器的甲烷的物质的量__________;
(2)平衡时CH4的体积分数__________;
(3)若温度不变时再向上述平衡混合物中加入0.01molH2O(g)和0.1molCO,平衡是否移动__________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.0molPCl3和1.0molCl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)PCl5(g)达平衡时,PCl5为0.4mol,如果此时移走1.0molPCl3和0.50molCl2,在相同温度下再达平衡时PCl5的物质的量是( )
A. 0.4mol
B. 0.2mol
C. 小于0.2mol
D. 大于0.2mol,小于0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B和Mg在材料科学领域有广泛的应用和发展前景。
回答下列问题:
(1)下列B原子轨道表达式表示的状态中,能量更高的是________![]() 填“A”或“B”
填“A”或“B”![]() 。
。
A. ![]() B.
B. ![]()
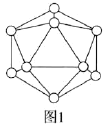
(2)晶体硼中的基本单元如图1所示,其中含有12个B原子。![]() 该单元中含有
该单元中含有![]() 键的数目为________。
键的数目为________。
(3)![]() 是重要的还原剂。其中阴离子的立体构型为________,中心原子的杂化形式为________。
是重要的还原剂。其中阴离子的立体构型为________,中心原子的杂化形式为________。
(4)基态Mg原子的核外电子排布式为________;第三周期主族元素中,电负性小于Mg元素的有________![]() 填元素符号,下同
填元素符号,下同![]() ,原子第一电离能小于Mg原子的有________。
,原子第一电离能小于Mg原子的有________。
(5)![]() 和
和![]() 均可作为耐火材料,其原因是________。
均可作为耐火材料,其原因是________。
(6)![]() 常用于光学仪器,其长方体型晶胞结构如图2所示:
常用于光学仪器,其长方体型晶胞结构如图2所示:
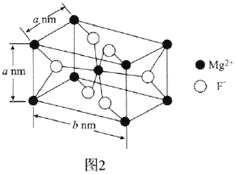
![]() 的配位数为________。
的配位数为________。
![]() 若阿伏加德罗常数的值为
若阿伏加德罗常数的值为![]() ,则
,则![]() 晶体的密度可表示为________
晶体的密度可表示为________![]() 用含a、b、
用含a、b、![]() 的代数式表示
的代数式表示![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在一定体积的密闭容器中,下列叙述不能作为可逆反应A(g)+3B(g) ![]() 2C(g)达到平衡状态标志的是 ( )
2C(g)达到平衡状态标志的是 ( )
①C的生成速率与C的消耗速率相等
②单位时间内生成a mol A,同时生成3a mol B
③A、B、C的浓度不再变化
④C的物质的量不再变化
⑤混合气体的总压强不再变化
⑥混合气体的总物质的量不再变化
⑦单位时间消耗a mol A,同时生成3a mol B
⑧A、B、C的分子数之比为1∶3∶2
A. ②⑧B. ④⑦C. ①③D. ⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com