
����Ŀ������CoCl2��Һ�ܷ������±仯��
CoCl2![]() Co(OH)2
Co(OH)2![]() [Co(NH3)6]2+
[Co(NH3)6]2+![]() X
X![]() ����Y��CoCl3��5NH3��
����Y��CoCl3��5NH3��
��X��Һ�м���ǿ������������а����ų���ͬʱ����Co2O3����������Y����Һ�м�AgNO3��Һ����AgCl�������ɣ��˳�������������Һ�м���AgNO3��Һ�ޱ仯��������������ʱ����AgCl�������ɣ��������Ϊ�ϴγ�������һ�롣��ش��������⣺
(1)��Ӧ�ڵ����ӷ���ʽ��__________________________________________��
(2)��Ӧ�١���������������ԭ��Ӧ����______�������Y�Ļ�ѧʽΪ______��
����һ�������£��������ʵ�����CH4��H2O(g)����1L�����ܱ�������������ӦCH4(g)��H2O(g) ![]() CO(g)��3H2(g)���ﵽƽ��ʱ���CO�����ʵ���Ϊ0.10mol����ƽ�ⳣ��K��27���Լ��㣨Ҫ��д��������̣�������������λ��Ч���֣���
CO(g)��3H2(g)���ﵽƽ��ʱ���CO�����ʵ���Ϊ0.10mol����ƽ�ⳣ��K��27���Լ��㣨Ҫ��д��������̣�������������λ��Ч���֣���
(1)��ʼ���������ļ�������ʵ���__________��
(2)ƽ��ʱCH4���������__________��
(3)���¶Ȳ���ʱ��������ƽ�������м���0.01molH2O(g)��0.1molCO��ƽ���Ƿ��ƶ�__________��
���𰸡�Co(OH)2+6NH3��H2O=[Co(NH3)6]2++2OH-+6H2O �� [Co(NH3)5Cl]Cl2 0.11mol 2.4% ���ƶ�
��������
��I��������ڽ��ڳ�����һ�㲻�������룬�ڼ��������»ᷢ�����룬�ݴ˽����ط�Ӧ�����жϣ�
��II���г�����ʽ����������ƽ��Ũ�ȣ�����ƽ�ⳣ���������ij�ʼ���ʵ��������������������ƽ��ʱ������������������Ũ������ƽ�ⳣ��֮���ϵ�ж�ƽ���Ƿ��ƶ���
��I����1����ͼ��֪����Ӧ��ΪCo(OH)2��NH3��H2O��Ӧ���� [Co(NH3)6]2+�������ӷ�Ӧ����ʽΪ��Co(OH)2+6NH3��H2O=[Co(NH3)6]2++2OH-+6H2O��
�ʴ�Ϊ��Co(OH)2+6NH3��H2O=[Co(NH3)6]2++2OH-+6H2O��
��2��������X��Һ�м���ǿ������������а����ų���ͬʱ����Co2O3��������֪��X�е�CoԪ�ػ��ϼ�Ϊ+3�ۣ��ɴ˿�֪����Ӧ�١���������������ԭ��Ӧ���Ǣڣ�
CoCl3��5NH3ˮ����Һ����AgNO3����AgCl�������ɣ�˵�����������Cl-�����˺��ټ�AgNO3��Һ����Һ���ޱ仯����������������AgCl�������ɣ�˵�������к���Cl-����������Ϊ��һ�γ������Ķ���֮һ��˵�����������Cl-������Cl-֮��Ϊ2��1���������Y�Ļ�ѧʽΪ[Co(NH3)5Cl]Cl2��
�ʴ�Ϊ���ڣ�[Co(NH3)5Cl]Cl2��
��II�������CH4�����ʵ���Ϊxmol����
CH4(g)��H2O(g)![]() CO(g)��3H2(g)
CO(g)��3H2(g)
��ʼŨ��(mol/L) x x 0 0
ת��Ũ��(mol/L) a a a 3a
ƽ��Ũ��(mol/L) x-a x-a a 3a
�����֪��a=0.1����ƽ�ⳣ��K=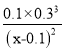 =27�����x=0.11��
=27�����x=0.11��
��1��������������֪����ʼ���������м�������ʵ���Ϊ0.11mol��
�ʴ�Ϊ��0.11mol��
��2��ƽ��ʱ������������=![]() ��100%=2.4%��
��100%=2.4%��
�ʴ�Ϊ��2.4%��
��3��������ƽ�������м���0.01molH2O(g)��0.1molCO��c(CO)=(0.1+0.1)mol/L=0.2mol/L��c(H2O)=(0.01+0.01)mol/L=0.02mol/L��Ũ����QC=![]() =27=K������ƽ�ⲻ�ƶ���
=27=K������ƽ�ⲻ�ƶ���
�ʴ�Ϊ�����ƶ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���£�N2H4������ȼ�ϵ�ص�ԭ��ʾ��ͼ��ͼ��ʾ������ܷ�ӦΪ��N2H4+O2=N2+2H2O������˵��������ǣ� ��
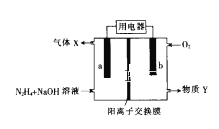
A.�缫b����������Ӧ
B.�����ɵ缫b�������õ�������缫a
C.����Y��NaOH��Һ
D.�缫a�ĵ缫��ӦʽΪ��N2H4��4OH����4e��=N2����4H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() Ϊ�����ӵ�������ֵ������������ȷ����
Ϊ�����ӵ�������ֵ������������ȷ����
A.���³�ѹ�£�![]() ��
��![]() �к��е�������Ϊ
�к��е�������Ϊ![]()
B.��![]() ����ϡ��ˮ�У�������Һ�����ԣ�����Һ��
����ϡ��ˮ�У�������Һ�����ԣ�����Һ��![]() ����ĿΪ
����ĿΪ![]()
C.![]() ��
��![]() �ڴ����ͼ��������³�ַ�Ӧ����NO�ķ�����Ϊ
�ڴ����ͼ��������³�ַ�Ӧ����NO�ķ�����Ϊ![]()
D.�����£�![]() ��
��![]() ��Һ�У����������ˮ������Ϊ
��Һ�У����������ˮ������Ϊ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����100mL 0.01mol��L-1��NaHA��Һ�зֱ����Ũ�Ⱦ�Ϊ0.01mol��L-1��NaOH��Һ�����ᣬ�����Һ��pH��������Һ����ı仯��ͼ��ʾ(���Թ����е�����仯)������˵������ȷ����
A. 25��ʱ��H2A�ĵڶ�������ƽ�ⳣ��ԼΪ10-6
B. ˮ�ĵ���̶ȣ�N��M��P
C. ��������IJ��ϵ��룬������Һ��pHС��2
D. P��ʱ��Һ�д��ڣ�2c(H2A)+c(HA-)+c(H+)=c(OH-)+c(Na+)+c(Cl-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����ʱ��![]() ijһԪ��HA��ˮ����
ijһԪ��HA��ˮ����![]() �������룬������������ȷ����
�������룬������������ȷ����![]()
�ٸ���Һ��![]() ��
��
�������¶ȣ���Һ��pH����
�۴���ĵ���ƽ�ⳣ��ԼΪ![]() ��
��
�ܼ�ˮϡ�ͺ����ӵ�Ũ�Ⱦ���С��
����HA�������![]() ԼΪˮ�������
ԼΪˮ�������![]() ��
��![]() ����
����
���ʵ�����HA��Ũ�ȣ�HA�ĵ���ƽ�������ƶ�������ƽ�ⳣ������
A.�ڢܢ�B.�٢ܢ�C.�ڢݢ�D.�ڢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����Ȼ�ѧ����ʽ��
(1)CH3COOH(l)��2O2(g)==2CO2(g)��2H2O(l) ��H1����870.3 kJ��mol��1
(2)C(s)��O2(g)===CO2(g) ��H2����393.5 kJ��mol��1
(3)H2(g)��![]() O2(g)===H2O(l) ��H3����285.8 kJ��mol��1��
O2(g)===H2O(l) ��H3����285.8 kJ��mol��1��
��Ӧ2C(s)��2H2(g)��O2(g)===CH3COOH(l)���ʱ���HΪ
A.+ 488.3 kJ��mol��1B.��244.15 kJ��mol��1
C.+ 244.15 kJ��mol��1D.��488.3 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ������ȼ�ϵ�أ����Զ������Ϊ�缫����KOH��Һ�У�Ȼ��ֱ���������ͨ���������������缫��ӦʽΪ��C2H6��18OH�� �C14e����2CO![]() ��12H2O��7H2O��7/2O2��14e����14OH�����йش˵�ص��ƶ���ȷ����( )
��12H2O��7H2O��7/2O2��14e����14OH�����йش˵�ص��ƶ���ȷ����( )
A��ͨ�����ĵ缫Ϊ����
B���μӷ�Ӧ��������C2H6�����ʵ���֮��Ϊ7��2
C���ŵ�һ��ʱ���KOH�����ʵ���Ũ�Ȳ���
D���������Һ�У�CO![]() �������ƶ�
�������ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ȼ���зdz���ɢ������û�бȽϼ��е������˱����dz�Ϊ��ϡɢ���������ش��������⣺
��1����̬��ԭ�����������Ų�ͼΪ_______��Geԭ�ӵĵ��ӷ���ԾǨʱ�����ջ�ų���ͬ�Ĺ⣬����_______![]() ����������
����������![]() ��ȡ��ԭ�ӹ��ף��Ӷ�����GeԪ�صĴ��ڡ�
��ȡ��ԭ�ӹ��ף��Ӷ�����GeԪ�صĴ��ڡ�
��2����Ԫ�����γ���������![]() �������ƣ�
�������ƣ�![]() ���������ƣ�
���������ƣ�![]() ���������ƣ�
���������ƣ�![]() ��
��![]() ��Ҳ���γ�����������������
��Ҳ���γ�����������������![]() ��
��
![]() ����ԭ�ӵ��ӻ���ʽΪ______________��
����ԭ�ӵ��ӻ���ʽΪ______________��
![]() ����̼ͬ�壬���ʼ��ṹ��һ���������ԣ��ݴ��Ʋ�
����̼ͬ�壬���ʼ��ṹ��һ���������ԣ��ݴ��Ʋ�![]() ��������
��������![]() �к��е�
�к��е�![]() ������ĿΪ_________��
������ĿΪ_________��
![]() ����û�з���n����5�����飬�����±��ṩ�����ݷ������е�ԭ��___________________��
����û�з���n����5�����飬�����±��ṩ�����ݷ������е�ԭ��___________________��
��ѧ�� |
|
|
|
|
���� | 346 | 411 | 188 | 288 |
��3���л���Ԫ��������������![]() ��
��![]() ��
��![]() �γɵģ���ṹ���£�
�γɵģ���ṹ���£�
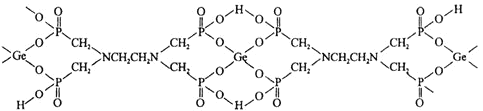
![]() ��������У����������������ڵ���_________
��������У����������������ڵ���_________
A.���Լ� ![]() �Ǽ��Լ�
�Ǽ��Լ� ![]() ������
������ ![]() ���
��� ![]() ���
��� ![]() ��
��
![]() ���������
���������![]() ��
��![]() ����λ����_______����λԭ����_______
����λ����_______����λԭ����_______![]() ��Ԫ�ط���
��Ԫ�ط���![]() ��
��
![]() �Խ�������
�Խ�������![]() ����Ϊʲô�������������______________��
����Ϊʲô�������������______________��
��4��![]() ����Ϊ�����ϵĺ����Ƶ����ϣ������뾧����ͼ��ʾ����þ�������
����Ϊ�����ϵĺ����Ƶ����ϣ������뾧����ͼ��ʾ����þ�������![]() ��
��![]() ���þ�����ܶ�Ϊ_______
���þ�����ܶ�Ϊ_______![]() �г���ʽ���ɣ������ӵ�������
�г���ʽ���ɣ������ӵ�������![]() ��ʾ
��ʾ![]() ��
��

![]() ԭ�ӵķ������꼴����������a��b��c��������1�����ó�����ά�ռ����꣬��1��ZnΪ����ԭ�㣬��
ԭ�ӵķ������꼴����������a��b��c��������1�����ó�����ά�ռ����꣬��1��ZnΪ����ԭ�㣬��![]() ����ͼ�б��Ϊ��2����Pԭ�ӵķ�������Ϊ_______��
����ͼ�б��Ϊ��2����Pԭ�ӵķ�������Ϊ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij�¶�ʱ�� ![]() ��ˮ����
��ˮ���� ![]() �����У���Һ pH���¶�����백ˮ����仯������ͼ��ʾ�������й�˵����ȷ����
�����У���Һ pH���¶�����백ˮ����仯������ͼ��ʾ�������й�˵����ȷ����

A.![]()
B.ˮ�ĵ���̶ȣ�![]()
C.c�㣺![]()
D.d�㣺![]()
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com