
【题目】肼(N2H4)碱性燃料电池的原理示意图如图所示,电池总反应为:N2H4+O2=N2+2H2O。下列说法错误的是( )
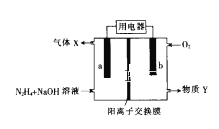
A.电极b发生氧化反应
B.电流由电极b流出经用电器流入电极a
C.物质Y是NaOH溶液
D.电极a的电极反应式为:N2H4+4OH--4e-=N2↑+4H2O
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,11.2LNH3和HCl的混合气体中的分子数为0.5NA
B.0.1molC2H6O分子中含有C—H键的数目为0.5NA
C.0.1molCl2通入适量水中,转移的电子数为0.1NA
D.17gH2O2与17gH2S所含的电子数均为9NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏伽德罗常数的值.下列有关叙述正确的是
为阿伏伽德罗常数的值.下列有关叙述正确的是![]()
A.硝酸与铜反应得到![]() 、
、![]() 共23g,则铜失去的电子数为
共23g,则铜失去的电子数为![]()
B.10g![]() 的乙醇水溶液中所含氢原子数目为
的乙醇水溶液中所含氢原子数目为![]()
C.标准状况下![]() 的平均相对分子质量为
的平均相对分子质量为![]() 的
的![]() 与
与![]() 含有中子数
含有中子数![]()
D.1molCu与足量的S完全反应,转移电子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是
A.已知:![]()
![]() :
:![]()
![]() ,则
,则![]()
B.已知:![]()
![]() ,则
,则![]() 的燃烧热
的燃烧热![]()
C.已知:![]()
![]() ,则稀
,则稀![]() 和稀
和稀![]() 完全反应生成
完全反应生成![]() 时,放出
时,放出![]() 热量
热量
D.已知:正丁烷![]() 异丁烷
异丁烷![]()
![]() ,则正丁烷比异丁烷稳定
,则正丁烷比异丁烷稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
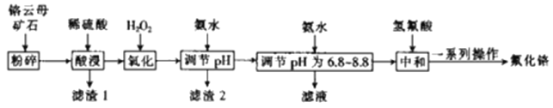
【题目】氟化铬可用作毛织品防蛀剂、卤化催化剂、大理石硬化及着色剂。以铬云母矿石(含4.5%Cr2O3,还含Fe2O3、FeO、MgO、SiO2)为原料制备氟化铬的工艺流程如下。
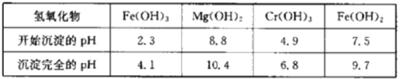
下表列出了相关金属离子生成氢氧化物沉淀的pH:
请回答下列问题:
(1)Fe2O3、MgO、FeO、SiO2中属于碱性氧化物的有___种。
(2)将铬云母矿石粉碎的目的是___。
(3)滤渣1主要成分的用途是___。(写一种)
(4)Cr2O3与稀硫酸反应的化学方程式为___。
(5)第一次滴加氨水调节pH范围为___。
(6)第二次滴加氨水调节pH为6.8~8.8的目的是___,Cr(OH)3与Al(OH)3一样具有两性,若第二次滴加的氨水改为NaOH溶液,生成的Cr(OH)3会部分溶解,写出Cr(OH)3溶解的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在科学家正在寻求将太阳能转化成化学能的方法,其中之一就是利用太阳能将![]() 分解成
分解成![]() ,再将化学能转化为其他能源。下面是有关的能量循环示意图,下列有关说法正确的是
,再将化学能转化为其他能源。下面是有关的能量循环示意图,下列有关说法正确的是
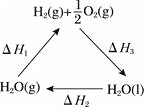
A.图中![]()
B.如果![]() 的键能为
的键能为![]() ,
,![]() 键能为
键能为![]() ,则断开
,则断开![]() 水蒸气中
水蒸气中![]() 键所需要的太阳能为
键所需要的太阳能为![]()
C.![]() 燃烧热为
燃烧热为![]()
D.水蒸气所具有的能量比液态水多![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油产品中含有H2S及COS、CH3SH等多种有机硫,石油化工催生出多种脱硫技术。请回答下列问题:
(1)已知热化学方程式:①2H2S(g)+SO2(g)=3S(s)+2H2O(l) △H=-362kJ·mol-1
②2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H2=-1172 kJ·mol-1
则H2S气体和氧气反应生成固态硫和液态水的热化学方程式为___。
(2)可以用K2CO3溶液吸收H2S,其原理为K2CO3+H2S=KHS+KHCO3,该反应的平衡常数为___。(已知H2CO3 的Ka1=4.2×10-7,Ka2=5.6×10-11;H2S的Ka1=5.6×10-8,Ka2=1.2×10-15)
(3)在强酸溶液中用H2O2 可将COS氧化为硫酸,这一原理可用于COS的脱硫。该反应的化学方程式为___。
(4)COS的水解反应为COS(g)+H2O(g)![]() CO2(g)+H2S(g) △H<0。某温度时,用活性α-Al2O3作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比[n(H2O)/n(COS)]的转化关系如图1所示。其它条件相同时,改变反应温度,测得一定时间内COS的水解转化率如图2所示:
CO2(g)+H2S(g) △H<0。某温度时,用活性α-Al2O3作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比[n(H2O)/n(COS)]的转化关系如图1所示。其它条件相同时,改变反应温度,测得一定时间内COS的水解转化率如图2所示:

①该反应的最佳条件为:投料比[n(H2O)/n(COS)]=___,温度___。
②P点对应的平衡常数为___。(保留小数点后2位)
③当温度升高到一定值后,发现一定时间内COS(g)的水解转化率降低;猜测可能的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用浓度为0.100 0 mol·L-1的氢氧化钠溶液分别滴定20.00 mL浓度均为0.100 0 mol·L-1的二种酸HX、HY(忽略体积变化),实验数据如下表,下列判断不正确的是 ( )
数据编号 | 滴入NaOH(aq)的体积/mL | 溶液的pH | |
HX | HY | ||
① | 0 | 3 | 1 |
② | a | 7 | x |
③ | 20.00 | >7 | y |
A. 在相同温度下,同浓度的两种酸溶液的导电能力:HX<HY
B. 由表中数据可估算出Ka(HX)≈10-5
C. HY和HX混合,c(H+)=c(X-)+c(Y-)+c(OH-)
D. 上述②反应后的HY溶液中:c(Na+)>c(Y-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)CoCl2溶液能发生如下变化:
CoCl2![]() Co(OH)2
Co(OH)2![]() [Co(NH3)6]2+
[Co(NH3)6]2+![]() X
X![]() 晶体Y(CoCl3·5NH3)
晶体Y(CoCl3·5NH3)
向X溶液中加入强碱并加热至沸腾有氨气放出,同时产生Co2O3沉淀;若向Y的溶液中加AgNO3溶液,有AgCl沉淀生成,滤出沉淀,再向滤液中加入AgNO3溶液无变化,但加热至沸腾时又有AgCl沉淀生成,其沉淀量为上次沉淀量的一半。请回答下列问题:
(1)反应②的离子方程式是__________________________________________。
(2)反应①~③中属于氧化还原反应的是______,配合物Y的化学式为______。
(Ⅱ)一定条件下,将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,发生反应CH4(g)+H2O(g) ![]() CO(g)+3H2(g),达到平衡时测得CO的物质的量为0.10mol。若平衡常数K=27,试计算(要求写出计算过程,计算结果保留两位有效数字):
CO(g)+3H2(g),达到平衡时测得CO的物质的量为0.10mol。若平衡常数K=27,试计算(要求写出计算过程,计算结果保留两位有效数字):
(1)初始加入容器的甲烷的物质的量__________;
(2)平衡时CH4的体积分数__________;
(3)若温度不变时再向上述平衡混合物中加入0.01molH2O(g)和0.1molCO,平衡是否移动__________?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com