
【题目】如图所示甲、乙是电化学实验装置:
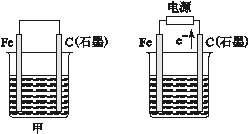 乙
乙
(1)若甲、乙两烧杯中均盛有NaCl溶液。
①甲中石墨棒上的电极反应式为_________________________________________________。
②乙中总反应的离子方程式为___________________________________________________。
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应中Cl2和I2的物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为_____。
(2))若甲、乙两烧杯中均盛有CuSO4溶液:
①甲中铁棒上的电极反应式为___________________________________________________。
②如果起始时乙中盛有200 mL pH=5的CuSO4溶液(25 ℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入_____________________(填写物质的化学式)______________g。
【答案】 O2+2H2O+4e-===4OH- 2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑ 5Cl2+I2+6H2O===10HCl+2HIO3 Fe-2e-=Fe2+ CuO (或CuCO3) 0.8 (或1.24)
2OH-+H2↑+Cl2↑ 5Cl2+I2+6H2O===10HCl+2HIO3 Fe-2e-=Fe2+ CuO (或CuCO3) 0.8 (或1.24)
【解析】本题考查原电池的工作原理和电解原理,以及电极反应式的书写,(1)①甲中铁作负极,石墨作正极,发生吸氧腐蚀,石墨电极反应式为O2+2H2O+4e-=4OH-;②根据电子流动方向,铁作阴极,此装置是电解饱和食盐水,因此总电极反应式为:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑;③Cl2作氧化剂,被还原成Cl-,I2为还原剂,根据得失电子数目守恒,因此有5×2×1=1×(x-0)×2,x=5,I被氧化成HIO3,因此反应方程式为:5Cl2+I2+6H2O=10HCl+2HIO3;(2)①甲中发生Fe+Cu2+=Fe2++Cu,铁作负极,电极反应式为Fe-2e-=Fe2+;②乙中发生总反应是2CuSO4+2H2O
2OH-+H2↑+Cl2↑;③Cl2作氧化剂,被还原成Cl-,I2为还原剂,根据得失电子数目守恒,因此有5×2×1=1×(x-0)×2,x=5,I被氧化成HIO3,因此反应方程式为:5Cl2+I2+6H2O=10HCl+2HIO3;(2)①甲中发生Fe+Cu2+=Fe2++Cu,铁作负极,电极反应式为Fe-2e-=Fe2+;②乙中发生总反应是2CuSO4+2H2O![]() Cu+O2↑+2H2SO4,恢复到电解前的状态,需要加入CuO或CuCO3,pH=1此时溶液中n(H+)=200×10-3×0.1mol=0.02mol,如果加入CuO,则需要的m(CuO)=0.02×80/2g=0.8g,假如加入CuCO3,m(CuCO3)=0.02×124/2g=1.24g。
Cu+O2↑+2H2SO4,恢复到电解前的状态,需要加入CuO或CuCO3,pH=1此时溶液中n(H+)=200×10-3×0.1mol=0.02mol,如果加入CuO,则需要的m(CuO)=0.02×80/2g=0.8g,假如加入CuCO3,m(CuCO3)=0.02×124/2g=1.24g。


科目:高中化学 来源: 题型:
【题目】有机物A是烃,有机物B易溶于水,且1 mol B能跟足量的钠反应生成标准状况下的H2 11.2 L,但不能与NaHCO3溶液反应,已知A通过如下转化关系可制得化学式为C4H8O2的酯E,且当D―→E时,相对分子质量增加28。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
请回答下列问题:
(1)反应①的原子利用率为________。
(2)B的密度比水________,B中含氧官能团的名称为________。
(3)反应②的化学方程式为________________________________。
(4)反应③的反应类型为______________________。
(5)4.4 g C物质完全燃烧消耗________ mol氧气。
(6)若D―→E时,式量增加m,则B的相对分子质量为__________ (用含m的代数式表示) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国“神舟七号”载人飞船的火箭燃料主要是偏二甲肼(用R表示)和四氧化二氮,在火箭发射时,两者剧烈反应产生大量气体并释放出大量的热,该反应的化学方程式为:R+2N2O4═3N2+4H2O+2CO2,下列叙述错误的是
A. 此反应是氧化还原反应
B. R的分子式为C2H8N2
C. 在反应中N2O4做还原剂
D. 生成3mol N2时电子转移数为16mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,水的电离达到平衡:H2O![]() H++OH―;ΔH>0 。则下列叙述正确的是
H++OH―;ΔH>0 。则下列叙述正确的是
A. 向水中加入稀氨水,水的电离程度增大
B. 向水中加入少量固体醋酸钠,平衡逆向移动,c(H+)降低
C. 向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
D. 将水加热,平衡逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于能源,以下说法中不正确的是
A.煤、石油、天然气等燃料属不可再生能源
B.煤、石油、水煤气可从自然界直接获取,属一级能源
C.太阳能是一级能源、新能源、可再生能源
D.潮汐能来源于月球引力做功
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:N2(g)+3H2(g) 2NH3(g)△H=﹣192kJmol﹣1.向 M、N 中,都通入 xmol N2 和ymol H2的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是 ( )

A. 若x:y=1;2,则平衡时,M中的转化率:N2>H2
B. 若x:y=1:3,当M中放出热量172.8kJ时,N2的转化率为90%
C. 若x=1,y=3,则达到平衡时反应物的转化率N>M
D. 平衡时N2气体在两容器中体积分数可能相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式的是( )
A. Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-===2Fe2++I2+3H2O
B. 0.1 mol·L-1 NH4Al(SO4)2溶液与0.2 mol·L-1 Ba(OH)2溶液等体积混合:Al3++2SO![]() +2Ba2++4OH-===2BaSO4↓+AlO
+2Ba2++4OH-===2BaSO4↓+AlO![]() +2H2O
+2H2O
C. 向0.1 mol·L-1、pH=1的NaHA溶液中加入NaOH溶液:HA-+OH-===A2-+H2O
D. 向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O===HClO+HSO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列十种物质:
①H2O ②Cu ③NO ④SiO2 ⑤稀硫酸 ⑥氢氧化钡 ⑦饱和FeCl3溶液 ⑧氨水 ⑨稀硝酸 ⑩硫酸铝
根据上述提供的物质,回答下列问题:
(1)属于纯净物的是__________,属于电解质的是__________。(填数字序号)
(2)发生中和反应的离子方程式为H++OH-===H2O,该离子反应对应的化学方程式有__________________________________。
(3)实验室制备少量Fe(OH)3胶体所用到的物质有________(填数字序号),发生反应的离子方程式为_________________________。
(4)实验室配制0.5 mol·L-1 245 mL⑩的溶液,需要用到的玻璃仪器有玻璃棒、烧杯、胶头滴管、________,需要用托盘天平称取溶质的质量为________g,从配制好的溶液中取出100 mL,其中含有的SO42—数目为________(设NA为阿伏加德罗常数的值)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com